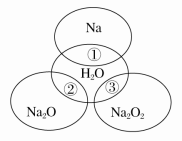
题目内容
【题目】有甲、乙两种物质:

(1)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
![]()
其中反应I的反应类型是___________,反应II的条件是_______________,反应III的化学方程式为___________________________________(不需注明反应条件)。
(2)下列物质不能与乙反应的是 (选填序号)。
a.金属钠 b.溴水 c.碳酸钠溶液 d.乙酸
(3)乙有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体结构简式 。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液显示紫色
【答案】(1)取代反应 NaOH溶液,加热 ![]()
(2)bc
(3)![]()
【解析】
试题分析:(1)由有机物结构可知,反应Ⅰ中甲物质中甲基上的H原子被氯原子取代,属于取代反应;反应II为NaOH水溶液、加热条件下的水解生成醇,反应III为碳碳双键与HCl的加成反应,反应方程式为:![]() 。
。
(2)乙含有苯环,能与氢气发生加成反应,含有羟基,能与Na、乙酸反应,不能与溴水、碳酸钠溶液反应,答案选bc。
(3)乙有多种同分异构体,同时满足下列条件:遇FeCl3溶液显示紫色,含有酚羟基,苯环上的一氯代物有两种,结合乙的结构可知,应含有2个不同的取代基且处于对位,符合条件的一种同分异构体的结构为![]() 。
。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目