题目内容
13.近年我国各地出现连续干旱,给生产生活带来严重影响,为确保人,畜用水和安全,水的净化和废水的排放尤为重要.Ⅰ.聚合氯化铝晶体([Al2(OH)nC16-n•xH2O]m)是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出.利用高岭土(化学组成为:A12O3、SiO2、Fe2O3、及少量杂质和水分,高岭土在煅烧的过程中可除去杂质和水分)制备聚合氯化铝,其制备过程有如图两种途径:
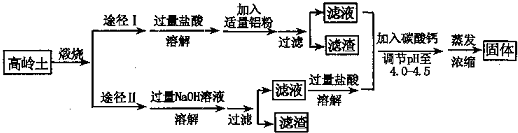
(1)途径I和途径Ⅱ哪种更合理?
(2)途径I中加入铝粉最主要的目的是c.
a.中和过量的盐酸 b.将Fe3+还原为便于人体吸收的Fe2+
c.除去溶液中的铁元素 d.制备生成聚合氯化铝所需要的AlCl3
(3)加入碳酸钙调节溶液pH至4.0~4.5的目的是促进AlCl3水解,使晶体析出.
Ⅱ.我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L.实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
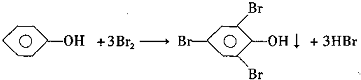
(1)请完成相应的实验步骤:
步骤l:准确量取25.00m1.待测废水于250ml.锥形瓶中.
步骤2:将4.50mL0.02mol/L溴水迅速加人到锥形瓶中,塞紧瓶塞,振荡.
步骤3:打开瓶塞,向锥形瓶中加人过量的0.1mol/LKI溶液,振荡.
步骤4滴入2~3滴淀粉溶液,用0.01mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液15.00mL.(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6
步骤5:将实验步骤1-4重复2次.
(2)该废水中苯酚的含量为18.8mg/L.
(3)步骤3若持续时间较长,则测得的废水中苯酚的含量偏低(填“偏高”、“偏低”或“无影响”).
分析 I.途径I:向固体中加入过量稀盐酸,发生反应:Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,向溶液中加入适量铝粉,发生反应2Al+6HCl=2AlCl3+3H2↑、Al+3Fe3+=Al3++3Fe2+、3Fe2++2Al=2Al3++3Fe,过滤除去滤渣SiO2 、Fe,滤液中只含AlCl3;
途径II:向固体中加入过量NaOH溶液,发生反应Al2O3+2NaOH=2 NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,过滤得到滤渣Fe2O3,滤液中含有NaAlO2、Na2SiO3,然后向滤液中加入过量稀盐酸,发生反应NaAlO2+4HCl=NaCl+AlCl3+2H2O、Na2SiO3+2HCl=2NaCl+H2SiO3↓,需要过滤分离,滤液中含有NaCl、AlCl3;
然滤液中加入碳酸钙并调节溶液的pH至4.0-4.5,使促使氯化铝水解结晶,然后蒸发浓缩得到聚合氯化铝晶体([Al2(OH)nC16-n•xH2O]m);
Ⅱ.(1)步骤4,需要滴入淀粉溶液作指示剂,以便判断反应终点;
(2)根据关系式:Br2~I2~2Na2S2O3计算与苯酚反应后剩余的溴,进而计算与苯酚反应的溴,结合方程式计算废水中苯酚的质量,可得废水中苯酚的含量为;
(3)步骤3持续的时间长,导致KI被氧气氧化,计算测定剩余溴的量偏大,则测定苯酚量减少.
解答 解:I.途径I:向固体中加入过量稀盐酸,发生反应:Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,向溶液中加入适量铝粉,发生反应2Al+6HCl=2AlCl3+3H2↑、Al+3Fe3+=Al3++3Fe2+、3Fe2++2Al=2Al3++3Fe,过滤除去滤渣SiO2 、Fe,滤液中只含AlCl3;
途径II:向固体中加入过量NaOH溶液,发生反应Al2O3+2NaOH=2 NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,过滤得到滤渣Fe2O3,滤液中含有NaAlO2、Na2SiO3,然后向滤液中加入过量稀盐酸,发生反应NaAlO2+4HCl=NaCl+AlCl3+2H2O、Na2SiO3+2HCl=2NaCl+H2SiO3↓,需要过滤分离,滤液中含有NaCl、AlCl3;
然滤液中加入碳酸钙并调节溶液的pH至4.0-4.5,使促使氯化铝水解结晶,然后蒸发浓缩得到聚合氯化铝晶体([Al2(OH)nC16-n•xH2O]m).
(1)(1)①途径Ⅰ中滤液中只含氯化铝,途径II滤液中含有NaCl、AlCl3,且滤液中加入盐酸,缺少过滤分离除去硅酸,所以途径I更合理,
故答案为:途径Ⅰ;
(2)途径I中加入铝粉最主要的目的是:除去溶液中的铁元素,
故答案为:c;
(3)铝离子水解:Al3++3H2O?Al(OH)3+3H+,加入碳酸钙,降低氢离子浓度促进铝离子水解,有利于聚合氯化铝晶体析出,
故答案为:促进AlCl3水解,使晶体析出;
Ⅱ.(1)步骤4,硫代硫酸钠溶液滴定碘单质,需要加入淀粉溶液做指示剂,滴入2~3滴淀粉溶液,再用0.01mol/L Na2S2O3标准溶液滴定至终点;
故答案为;滴入2~3滴淀粉溶液;
②和碘化钾反应的溴单质物质的量:
Br2~I2~2Na2S2O3
1 2
n 0.01mol/L×0.015L
n=0.000075mol
n总(Br2)=0.0045L×0.02mol/L=0.00009mol,
故与苯酚反应的溴单质为0.00009mol-0.000075mol=0.000015mol
则苯酚物质的量=$\frac{1}{3}$×0.000015mol=0.000005mol
该废水中苯酚的含量为0.000005mol×94g/mol÷0.025L=0.0188g/L=18.8mg/L,
故答案为:18.8;
③步骤3持续的时间长,导致KI被氧气氧化,计算测定剩余溴的量偏大,则测定苯酚量减少,测定结果偏低;
故答案为:偏低.
点评 本题考查化学工艺流程制备方案、物质含量测定,属于拼合型题目,设计对工艺流程的理解、除杂、氧化还原反应滴定应用等,需要学生具备扎实的基础,难度中等.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案I.【查阅资料】
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| Sn | 231 | 227 | 加热时与Cl2反应生成SnCl4 |
| SnCl2 | 246 | 652 | Sn2+易被Fe3+、O2等氧化 |
| SnCl4 | -33 | 114 | 极易水解 |
实验装置如图所示(省略夹持和加热装置)
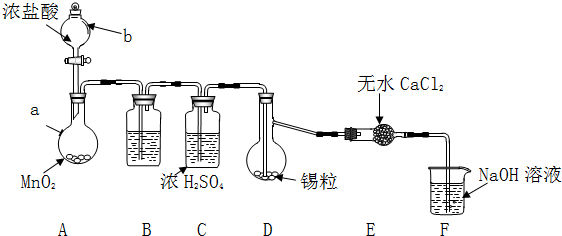
实验步骤:
(1)检查装置气密性后,按图示加入试剂.仪器b的名称是分液漏斗,其中无水CaCl2的作用是吸收水蒸气,防止进入D中使SnCl4水解,B中的试剂是C(选填下列字母编号).
A.Na2CO3 溶液 B.NaOH溶液 C.饱和NaCl溶液 D.NaHCO3溶液
(2)先向A中烧瓶内加入盐酸并加热a,当整个装置充满黄绿色气体后(填实验现象),再加热熔化锡粒,反应完后,停止加热.
(3)待反应结束后,经过滤(填写操作名称)、洗涤、干燥,可回收利用装置A中未反应完的MnO2.
Ⅲ.[探究与反思]
(1)装置F中吸收Cl2发生反应的离子方程式是2OH-+Cl2=Cl-+ClO-+H2O.
(2)实验在D中得到的产品很少,经分析装置设计有缺陷,应在D和E之间补充连有冷凝管的集气瓶(填装置名称).
(3)为验证产品中是否含有SnCl2,该小组设计了以下实验方案:(所需试剂从稀HNO3、稀HCl、FeCl3溶液、FeCl2溶液、KSCN溶液、蒸馏水中选择)
取适量0.5mL产品溶入20mL蒸馏水中,加入适量稀HCl和KSCN溶液,再滴入几滴FeCl3溶液,若不出现红色(填实验现象),则含有SnCl2,否则无SnCl2.
 如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )
如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法不正确的是( )| A. | 此电池的能量转化率未达到100% | |
| B. | 铝罐将逐渐被腐蚀,电池供电时铝罐上发生氧化反应 | |
| C. | 炭棒应与玩具电机的正极相连 | |
| D. | 电池工作一段时间后炭棒和碳粒的质量会减轻 |
| A. | 7种 | B. | 9种 | C. | 12种 | D. | 14种 |
| A. | 灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W重新沉积到灯丝上 | |
| B. | 灯丝附近温度越高,WI2(g)的转化率越低 | |
| C. | 该反应的平衡常数表达式是K=$\frac{c(W)•c({I}_{2})}{c(W{I}_{2})}$ | |
| D. | 灯内温度升高时,压强不会变 |
| A. | NaOH,KOH,CsOH碱性依次减弱 | B. | HCl,PH3,H2S稳定性依次减弱 | ||
| C. | Na,Mg,Al还原性依次减弱 | D. | S2-,Cl-,Ca2+半径依次增大 |
