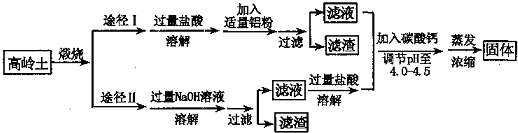
题目内容
3.某课外活动小组利用下图装置进行乙醇的催化氧化实验,图中铁架台等装置已略去,粗黑线表示乳胶管.请填写下列空白: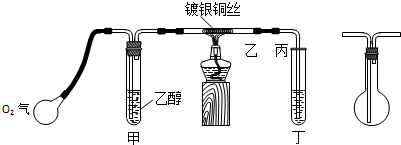
(1)为了加快反应速率,可以采用的措施是将盛有乙醇的试管浸在70~80℃的水浴中
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态.该反应的化学方程式为2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+H2O.
(3)乙醛沸点是20.8℃,乙醇的沸点是78.5℃,都易溶于水,如何从丁装置获得较为纯净的乙醛?请说明所用的试剂及步骤.
(4)请指出该装置的不合理的地方,并提出你的改进方法.
分析 (1)升高温度促进乙醇的挥发,增大乙醇的浓度,可以加快反应速率;
(2)乙醇发生催化氧化生成乙醛和水;
(3)依据乙醇与乙醛沸点不同,二者相互溶解,应选择蒸馏的方法分离;
(4)乙醛易挥发且有毒,应用冷水浴.
解答 解:(1)升高温度能促进乙醇的挥发,加快反应速率,所以可以将乙醇浸入浸在70~80℃的水浴中;
故答案为:将盛有乙醇的试管浸在70~80℃的水浴中;
(2)乙醇发生催化氧化生成乙醛和水,方程式为2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+H2O;
(3)乙醛沸点是20.8℃,乙醇的沸点是78.5℃,都易溶于水要想分离二者得到纯净的乙醛,应采取蒸馏的方法;
答:利用蒸馏的方法分离得到纯净的乙醛;
(4)乙醛沸点低,易挥发且有毒,应用冷水浴;
答:乙醛易挥发且有毒,应将丁浸入冷水浴.
点评 本题考查了乙醇的催化氧化,明确实验原理及发生的反应是解题关键,注意实验装置设计的严密性,题目难度中等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
11.下列各组物质中,属于同系物的是( )
| A. | CH4、C17H36 | B. | 醋酸CH3COOH、油酸C17H33COOH | ||
| C. |  、 、 | D. |  、 、 |
18.下列物质的制备方法恰当的是( )
| A. | 往95%酒精中加入无水氯化钙,蒸馏得到无水乙醇 | |
| B. | 往2mL 10% CuSO4 溶液中滴加几滴2% NaOH,然后滴加少量乙醛,加热制得砖红色沉淀Cu2O | |
| C. | 用氯气和乙烷按1:1体积比混合,光照条件下,制纯一氯乙烷 | |
| D. | 往装有电石的烧瓶中逐滴滴加饱和食盐水,制粗乙炔 |
15.下列实验操作正确的是( )
| A. | 蒸馏时,温度计水银球的位置应插入烧瓶的溶液中 | |
| B. | 配制溶液时,摇匀后发现液面低于刻度,加少量水至溶液凹液面恰好与刻度线相切 | |
| C. | 容量瓶用蒸馏水清洗后应烘干后使用 | |
| D. | 实验室制取蒸馏水时,冷凝管水流方向应从下到上,与蒸汽流动方向相反 |
12.下列提纯物质的方法正确的是( )
| A. | 用溶解、蒸馏的方法可以除去粗盐中的CaCl2、MgCl2等杂质 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量氢氧化铁胶体 | |
| C. | 用溶解、过滤、蒸发的方法提纯含有少量CaCO3的KCl | |
| D. | 用加硫酸钠溶液再过滤的方法提纯含少量硝酸钡的硝酸钾溶液 |