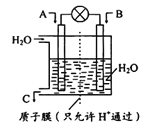
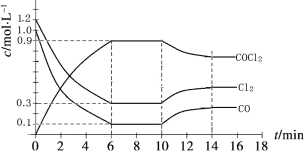
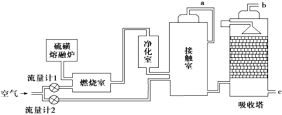
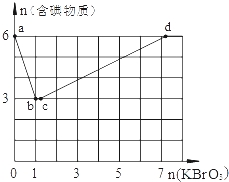
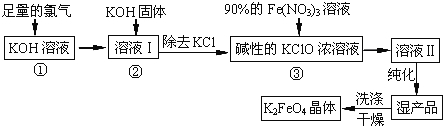
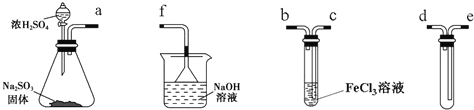
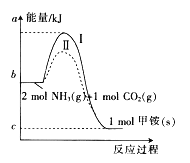
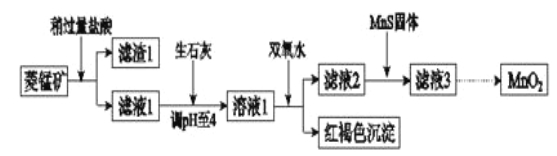
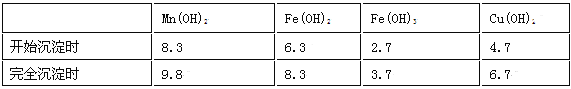
��Ŀ����
����Ŀ�����淴Ӧ��2NO2![]() 2NO+O2 �ں����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��( )
2NO+O2 �ں����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��( )
�ٵ�λʱ��������n molO2��ͬʱ����2n molNO2��
�ڵ�λʱ��������n molO2 ��ͬʱ����2n mol NO��
����NO2��NO��O2 �����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬��
�ܻ��������![]() ���䣻
���䣻
�ݻ���������ɫ���ٸı��״̬��
���������ܶȲ��ٸı��״̬��
��������ƽ����Է����������ٸı��״̬��
A���٢ݢ� B���٢ܢݢ� C���٢ݢޢ� D���٢ۢݢޢ�
���𰸡�B
��������
�����������ٸ��ݵ�λʱ��������nmolO2��ͬʱ����2nmol NO2 ����֪�������������ʺ�����������ȣ��ﵽ��ƽ��״̬���ʢ���ȷ���ڵ�λʱ��������nmolO2��ͬʱ����2nmol NO����������Ӧ���ʣ����ж��Ƿ�ﵽƽ�⣬�ʢڴ������κ�����£�ͬһ��Ӧ����ͬһʱ�������NO2��NO��O2 �����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵıȾ�Ϊ2��2��1���������ͬһ��Ӧ����ֻ�дﵽƽ����ͬʱ�ŷ��ϸñ�ֵ���ʢ۴��ܻ��������![]() ������˵�������ʵĺ������ٱ仯����Ӧ�Ѵﵽƽ��״̬��������ȷ�������������ɫ���ٸ��䣬˵�����ɵĶ������������ĵ�������ȣ���Ӧ�ﵽ��ƽ��״̬���ʢ���ȷ������Ӧǰ�����������������䡢����������䣬���Ի��������ܶ�ʼ�ղ��䣬�����жϷ�Ӧ�ﵽƽ��״̬��������������Ӧ��������ﶼ�����壬��Ӧǰ�������������䣬���ʵ�����ͬ��ƽ����Է����������ٸı䣬˵����Ӧ�ﵽƽ��״̬��������ȷ������������ѡ��B��ȷ��
������˵�������ʵĺ������ٱ仯����Ӧ�Ѵﵽƽ��״̬��������ȷ�������������ɫ���ٸ��䣬˵�����ɵĶ������������ĵ�������ȣ���Ӧ�ﵽ��ƽ��״̬���ʢ���ȷ������Ӧǰ�����������������䡢����������䣬���Ի��������ܶ�ʼ�ղ��䣬�����жϷ�Ӧ�ﵽƽ��״̬��������������Ӧ��������ﶼ�����壬��Ӧǰ�������������䣬���ʵ�����ͬ��ƽ����Է����������ٸı䣬˵����Ӧ�ﵽƽ��״̬��������ȷ������������ѡ��B��ȷ��