题目内容
【题目】氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
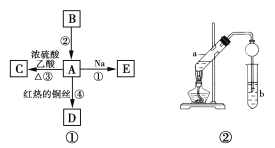
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要________(填仪器名称);
(2)装置C的作用是_____________________________;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______________________________________。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是___________________;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作③。
①55℃蒸发结晶; ②趁热过滤; ③___________;④低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是______;
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是_________________;
②所称取的样品中NaClO2的物质的量为_______________(用含c、V的代数式表示)。
【答案】 量筒 防止D瓶溶液倒吸到B瓶中(或安全瓶) 2ClO2+2NaOH+ H2O2 = 2NaClO2+O2+2H2O NaClO3和NaCl 用45℃左右的热水洗涤3遍(热水温度高于38℃,低于60℃) a 滴到最后一滴,溶液蓝色恰好褪去且半分钟内不复原 cV10-3mol
【解析】(1)用50%双氧水配制30%的H2O2溶液,需要的仪器有量筒、烧杯、玻璃棒、胶体滴管、容量瓶,所以玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要量筒。答案为:量筒
(2)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;答案为:防止D瓶溶液倒吸到B瓶中(或安全瓶)
(3)装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O,答案为:2ClO2+2NaOH+ H2O2 =2NaClO2+O2+2H2O
(4) 由题目信息可知,应控制温度38℃~60℃, 高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl。答案为:NaClO3和NaCl
(5)NaClO2饱和溶液在低于38℃时析出NaClO23H2O,从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,所以操作③为用45℃左右的热水洗涤3遍。答案为:用45℃左右的热水洗涤3遍(热水温度高于38℃,低于60℃)
(6)在B中可能发生反应Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,产生的SO2被带入D中,SO2与H2O2反应生成硫酸钠,a项正确;浓硫酸难挥发,不会进入D,b项错误;硫酸钠是难挥发的盐,也不会进入D,c项错误;选a。答案为:a
(7)①碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;②令样品中NaClO2的物质的量x,根据化学反应可得关系式,
NaClO2~2I2~4S2O32-
1mol4mol
0.25x c mol·L-1×V×10-3L
列方程解得x= cV10-3mol。答案为: ① 滴到最后一滴,溶液蓝色恰好褪去且半分钟内不复原 ② cV10-3mol

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】回答下列问题:
(1)下列反应属于放热反应的是_______。
A.铝片与稀H2SO4反应制取H2 B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解 D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl固体反应
(2)一定条件下,SO2与O2反应5min后,若SO2和SO3物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为______;用SO3表示这段时间该化学反应速率为_______。
(3)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从____处通入(填“a”或b”),电池内部H+向_____(填“左”或“右”)移动。写出正极的电极反应式________。

(4)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H-H | N—H | N≡N |
键能kJ/mol | 436 | a | 945 |
已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值_________。
【题目】从煤化工行业中可以得到许多重要的工业资源。回答下列问题:
(1)从煤的气化获得的化工原料气中含有的少量羰基硫(COS)会引起催化制中毒,大气污染等问题。
①羰基硫与烧碱溶液反应生成两种正盐的离子方程式为_________________________________。
②羰基硫的脱硫方法之一为COS(g)+H2(g)=H2S(g)+ CO(g) ΔH=+7kJ·mol-1,已知反应中部分物质的键能数据如下:
化学键 | C=O | C=S | H-S | H-H |
键能(kJ·mol-1) | 745 | 577 | 339 | 436 |
则CO分子中的碳氧键的键能为_________________。
(2)羰基硫在高温下发生水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g)。T℃时,将0.30 molCOS(g)与0.50mol H2O(g)充入10L的恒容密闭容器中,30 s后反应达到平衡状态,此时H2S的物质的量分数为0.30。
H2S(g)+CO2(g)。T℃时,将0.30 molCOS(g)与0.50mol H2O(g)充入10L的恒容密闭容器中,30 s后反应达到平衡状态,此时H2S的物质的量分数为0.30。
①0~30 s内,COS的平均反应速率v(COS)=___________,该反应的平衡常数K=__________(保留3位有效数字)。
②向反应容器中再分别充入下列气体,能使COS的转化率增大的是_________(填字母)。
A.COS B.H2O C.H2S D.CO2
(3)将含H2S尾气的空气按一定流速通入酸性FeCl3溶液中,可实现含H2S尾气的空气脱硫。在FeCl3 溶液吸收H2S的过程中,溶液中的n(Fe3+)及被吸收的n(H2S)随时间t的变化如图所示。

①由图中信息可知,0~t1时间段内,一定发生的反应是__________________________(用离子方程式表示)。
②t1时刻后,溶液中n(Fe3+)保持微量减少至基本不变,其原因是__________________________________。