题目内容
下列说法正确的是( )
A.如图可表示水分解过程中的能量变化 |
| B.若2C(s)+O2(g)=2CO(g)△H="-221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H="-" a kJ/mol, |

且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c
A
解析试题分析:图中产物的能量高于反应物的能量,为吸热反应,故可以表示水分解的能量变化;B中碳的燃烧热应该是生成物为CO2;碳的燃烧是放热反应,但需要加热,故C错误;断开1molH-Cl键所需的能量为 (a+b+c)/2,故D错
考点:考查基本理论,热化学

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
单斜硫和正交硫是硫的两种同素异形体。已知
①S(s,单斜)+O2(g)=SO2(g) ΔH1=-297.16 kJ/mol
②S(s,正交)+O2(g)=SO2(g) ΔH2=-296.83 kJ/mol
下列说法正确的是( )
| A.正交硫比单斜硫稳定 |
| B.S(s,单斜)=S(s,正交)ΔH3=+0.33 kJ/mol |
| C.相同物质的量的正交硫比单斜硫所含有的能量高 |
| D.①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJ |
下列说法中正确的是
| A.物质发生化学反应时不一定都伴随着能量变化 |
| B.伴有能量变化的变化都是化学变化 |
| C.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
| D.反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
H2(g)+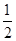 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
由此可知,在等温下蒸发36 g液态水需吸收的热量( )
| A.483.6 kJ | B.88 kJ | C.285.8 kJ | D.44 kJ |
肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化,如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1molN—H键所需的能量(kJ)是
| A.194 | B.391 |
| C.516 | D.658 |
分析能量变化示意图,下列选项正确的是
| A.S(s,单斜)+O2(g)=SO2(g)△H ="+297.16" kJ?mol-1 |
| B.S(s,单斜)+O2(g)=SO2(g)△H ="-296.83" kJ?mol-1 |
| C.S(s,正交)+O2(g)=SO2(g)△H ="-296.83" kJ?mol-1 |
| D.单斜硫比正交硫更稳定 |
下列反应中旧化学键断裂吸收的总能量大于新化学键形成放出总能量的是
| A.电解水制取H2和O2 | B.甲烷燃烧 |
| C.铝粉与氧化铁粉末反应 | D.油脂在人体内完全氧化生成CO2和H2O |
下列反应中的能量变化关系符合如图所示的是
| A.盐酸与烧碱反应 |
| B.天然气燃烧 |
| C.三氧化硫与水反应 |
| D.煅烧石灰石 |
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( ) 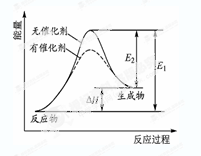
| A.该反应为放热反应 |
| B.催化剂能改变该反应的焓变 |
| C.催化剂能降低该反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |