题目内容
肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化,如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1molN—H键所需的能量(kJ)是
| A.194 | B.391 |
| C.516 | D.658 |
B
解析试题分析:依据盖斯定律有:△H1=△H2+△H3。所以△H3=△H1-△H2=-534-(-2752)=2218;假设断裂1molN—H键所需的能量(kJ)是xmol,H2N—NH2中有四摩尔的N—H键和一摩尔的N—N键,依题意有:4x+154+500=2218,解之得:x=391
考点:盖斯定律的有关知识。

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是 ( )
A.C(s)+ O2(g)=CO(g) ΔH=-393.5 kJ/mol O2(g)=CO(g) ΔH=-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g) ΔH=+571.6 kJ/mol |
C. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ/mol |
单斜硫和正交硫是硫的两种同素异形体。
已知:①S(s,单斜)+O2(g)=SO2 (g) △H1=-297.16kJ·mol-1
②S(s,正交)+O2(g)=SO2 (g) △H2=-296.83kJ·mol -1
下列说法正确的是
| A.S(s,单斜)=S(s,正交)△H3=+0.33kJ·mol -1 |
| B.正交硫比单斜硫稳定 |
| C.相同物质的量的正交硫比单斜硫所含有的能量高 |
| D.①式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量多297.16kJ |
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量,则下列说法正确的是( )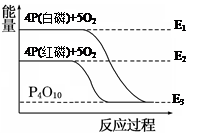
| A.白磷比红磷稳定 |
| B.白磷燃烧是吸热反应 |
| C.红磷转变为白磷是吸热反应 |
| D.红磷燃烧的热化学方程式:4P(s) + 5O2(g)=P4O10(s) ΔH=(E2-E3)kJ/mol |
下列说法正确的是( )
A.如图可表示水分解过程中的能量变化 |
| B.若2C(s)+O2(g)=2CO(g)△H="-221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H="-" a kJ/mol, |

且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c
化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是
| A.化学反应中能量变化的主要原因是化学键的断裂与生成 |
| B.铝热反应中, 反应物的总能量比生成物的总能量低 |
| C.图I所示的装置能将化学能转变为电能 |
| D.图II所示的反应为吸热反应 |
中和热测定实验中,通过简易量热计直接测得的数据是
| A.反应的热量变化 | B.体系的温度变化 |
| C.酸或碱的浓度变化 | D.生成水的物质的量 |
下列关于化学反应的描述中正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.已知NaOH(aq) +HCI(aq) =NaCI(aq)+H2O(1) △H= 一57.3 kJ·mol-1, 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 |
| C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为 2CO (g)+ O2(g)=2CO2(g) △H=一283.0 kJ·mol-1 |
| D.已知2C(s) +2O2(g)=2CO2(g) △H=a, 2C(s) +O2(g)="2CO" (g) △H=b,则b>a |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.实验室制备氢气 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与水的反应 | D.铝粉与氧化铁粉末反应 |