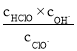题目内容
【题目】将3.2gCu与过量的8mol/L 40mL HNO3反应,硝酸的还原产物为NO2和NO,(体积变化忽略不计)反应结束后测得溶液中c(H+)为4 mol/L,则溶液中所含c(NO3-)为
A.4 mol/LB.5.6 mol/LC.6.5 mol/LD.6.3 mol/L
【答案】C
【解析】
铜与硝酸反应生成硝酸铜,一氧化氮和二氧化氮,依据题意可知反应后溶液中剩余硝酸铜和硝酸,依据硝酸根离子守恒计算解答。
3.2gCu物质的量为:![]() =0.05mol,与硝酸反应生成硝酸铜,一氧化氮和二氧化氮,反应后生成硝酸铜物质的量为0.05mol,剩余硝酸物质的量为:4mol/L×0.04L=0.16mol,所以共含有硝酸根离子物质的量为0.16mol+0.05mol×2=0.26mol,物质的量浓度c=
=0.05mol,与硝酸反应生成硝酸铜,一氧化氮和二氧化氮,反应后生成硝酸铜物质的量为0.05mol,剩余硝酸物质的量为:4mol/L×0.04L=0.16mol,所以共含有硝酸根离子物质的量为0.16mol+0.05mol×2=0.26mol,物质的量浓度c=![]() =6.5 mol/L,故答案选C。
=6.5 mol/L,故答案选C。

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目