题目内容
【题目】已知O2F2可以发生反应:H2S+4O2F2 = SF6+2HF+4O2,下列说法正确的是( )
A.SF6是还原产物
B.O2F2是还原剂
C.若生成3.2g O2,则转移0.2 mol e
D.还原剂与氧化剂的物质的量之比为4:1
【答案】C
【解析】
卤素最低只能是-1价,因此氧是+1价,标出化合价后本题即可顺水推舟。
A.硫元素的化合价从-2价升高到+6价,因此![]() 是氧化产物,A项错误;
是氧化产物,A项错误;
B.![]() 中的氧元素化合价从+1价降低到0价,因此
中的氧元素化合价从+1价降低到0价,因此![]() 是氧化剂,B项错误;
是氧化剂,B项错误;
C.根据反应方程式,每生成4mol氧气时一共转移8mol电子,因此若生成3.2g氧气(即0.1mol氧气)时,一共转移0.2mol电子,C项正确;
D.还原剂是![]() ,氧化剂是
,氧化剂是![]() ,它们的物质的量之比为1:4,D项错误;
,它们的物质的量之比为1:4,D项错误;
答案选C。

【题目】氨能源的循环利用是目前研究的热点之一。
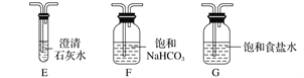
(1)一种可以快速启动的氨制氢工艺如图a所示:
已知:![]()
![]()
快速制氢反应:![]() 的
的![]() =__
=__![]()
(2)1100℃时,在钨丝表面NH3分解的半衰期(浓度减小一半所需时间)如下表所示:
c(NH3)/mol/L | 4.56×10-3 | 2.28×10-3 | 1.14×10-3 | 5.70×10-4 | 2.85×10-4 |
时间/s | 0 | 440 | 660 | 770 | t5 |
表中的t5的值为_________:c(NH3)的值从4.56×10-3变化至2.28×10-3的过程中,平均反应速率试v(H2)=_____________ (保留三位有效数字)mol·L-1·S-1。
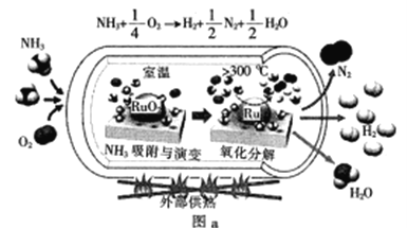
(3)在101kPa下,NH3分解的平衡转化率与温度的关系如图b所示:
①温度为300℃,总压为101kPa时,图b中v(正)>v(逆)的点是_____(填“a”“b”或“c”)。
②为降低NH3分解的活化能可采取的措施有_____________________________
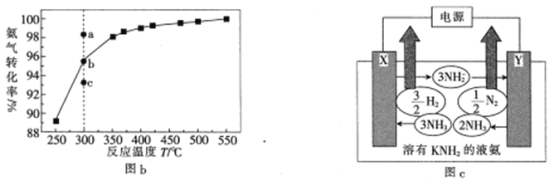
(4)已知液氮中存在下列平衡:2NH3(l)![]() NH4++NH2-。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图c所示:
NH4++NH2-。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图c所示:
①电极X的名称是__________________(填“阳极”或“阴极”)。
②图c中阳极的电极反应式为______________________________________________
③若图c中支持电解质改用NH4Cl,则阴极的电极反应式为__________________________