题目内容
【题目】常温下,在“H2S—HS-—S2-”的水溶液体系中,H2S、HS-、S2-三种微粒的物质的量分数随溶液pH变化(仅用H2S和NaOH调节pH)的关系如图所示。下列说法正确的是
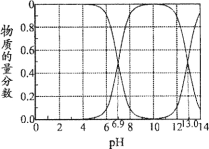
A.Kal(H2S)的数量级为10-6
B.NaHS溶液中,c(Na+)>c(HS-)>c(S2-)>c(H2S)
C.当体系呈中性时,![]() >
>![]()
D.加入Na2S沉降废水中的Cu2+,废水的pH对沉降效果没有影响
【答案】C
【解析】
根据多元弱酸的电离,一级电离远远大于二级电离,故第一个交点对应c(HS-)和c(H2S),第二个交点对应c(HS-)和c(S2-),再结合具体问题进行分析。
A.c(HS)=c(H2S)时,Ka1(H2S)= 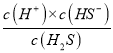 =c(H+)=106.9,数量级为10-7,故A错误;
=c(H+)=106.9,数量级为10-7,故A错误;
B.c(HS-)和c(S2-)时,Ka2(H2S)= 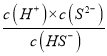 = c(H+)=1013,NaHS溶液中,Kh=
= c(H+)=1013,NaHS溶液中,Kh=![]() =
=![]() =10-7.1> Ka2(H2S)=1013,溶液呈碱性,说明HS水解程度大于电离程度,则c(S2)<c(H2S),故B错误;
=10-7.1> Ka2(H2S)=1013,溶液呈碱性,说明HS水解程度大于电离程度,则c(S2)<c(H2S),故B错误;
C.溶液呈中性时,c(H+)= c(OH-),c(HS)>c(H2S),则![]() >1、根据电荷守恒得c(Na+)=c(HS)+2c(S2),所以
>1、根据电荷守恒得c(Na+)=c(HS)+2c(S2),所以![]() =1,则
=1,则![]() >
>![]() ,故C正确;
,故C正确;
D.当加入Na2S沉降废水中的Cu2+,溶液中c(Cu2+)减小,Cu2+水解程度较小,则溶液的pH增大,故D错误;
答案选C。

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目