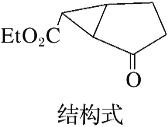
题目内容
【题目】设NA为阿伏加德罗常数的值。下列有关叙述错误的是( )
A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
B.1molNaBH4与足量水反应生成NaBO2和H2时转移的电子数为4NA
C.25℃,1LpH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9NA
D.相同质量的Na2O2和Na2S固体具有相同的阴阳离子数和质子数
【答案】C
【解析】
A.平均每个六元环拥有的碳为6×![]() =2,12g石墨烯(单层石墨)中含有六元环的个数为
=2,12g石墨烯(单层石墨)中含有六元环的个数为![]() =0.5NA,故A正确;
=0.5NA,故A正确;
B.1molNaBH4与足量水反应生成NaBO2和H2时,H由-1价变成0价,转移的电子数为4NA,故B正确;
C.CH3COONa属于强碱弱酸盐,CH3COO-的水解促进水的电离,c(H2O)电离=c(OH-)=1×10-5mol·L-1,发生电离的水分子物质的量为1×10-5mol·L-1×1L=1×10-5mol,发生电离的水分子数为1×10-5NA,故C错误;
D.O22-与S2-的摩尔质量相同,质子数相同,相同质量的Na2O2和Na2S固体具有相同的阴阳离子数和质子数,故D正确;
故选C。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】氨能源的循环利用是目前研究的热点之一。
(1)一种可以快速启动的氨制氢工艺如图a所示:
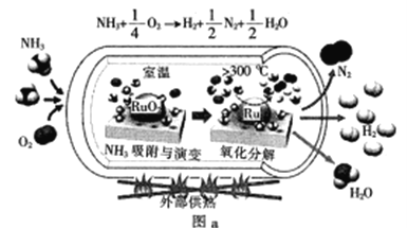
已知:![]()
![]()
快速制氢反应:![]() 的
的![]() =__
=__![]()
(2)1100℃时,在钨丝表面NH3分解的半衰期(浓度减小一半所需时间)如下表所示:
c(NH3)/mol/L | 4.56×10-3 | 2.28×10-3 | 1.14×10-3 | 5.70×10-4 | 2.85×10-4 |
时间/s | 0 | 440 | 660 | 770 | t5 |
表中的t5的值为_________:c(NH3)的值从4.56×10-3变化至2.28×10-3的过程中,平均反应速率试v(H2)=_____________ (保留三位有效数字)mol·L-1·S-1。
(3)在101kPa下,NH3分解的平衡转化率与温度的关系如图b所示:
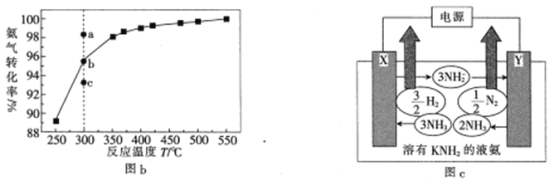
①温度为300℃,总压为101kPa时,图b中v(正)>v(逆)的点是_____(填“a”“b”或“c”)。
②为降低NH3分解的活化能可采取的措施有_____________________________
(4)已知液氮中存在下列平衡:2NH3(l)![]() NH4++NH2-。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图c所示:
NH4++NH2-。用溶有金属氨基化合物(如KNH2)的液氨作电解质电解制氢的工作原理如图c所示:
①电极X的名称是__________________(填“阳极”或“阴极”)。
②图c中阳极的电极反应式为______________________________________________
③若图c中支持电解质改用NH4Cl,则阴极的电极反应式为__________________________