题目内容
【题目】铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl22H20),为制取纯净的CuCl22H20,首先将其制成水溶液,然后按如图步骤进行提纯: 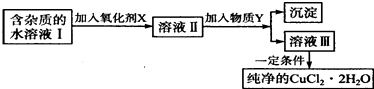
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
请回答下列问题.
(1)最适合作氧化剂X的是 .
A.K2Cr207
B.NaCl0
C.H202
D.KMn04
(2)加入的物质Y是 .
A.CuO
B.NaOH
C.Cu2(OH)2CO3
D.NH3
(3)由溶液Ⅲ获得CuCl22H2O,需要经过、、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用(“酸式”或“碱式”)滴定管.反应的化学方程式: .
【答案】
(1)C
(2)AC
(3)蒸发浓缩;冷却结晶
(4)酸式;MnO4﹣+8H++5Fe2+=Mn2++5Fe3++4H2O
【解析】解:(1)根据实验目的,加入氧化剂的目的是将Fe2+氧化成Fe3+ , 便于生成Fe(OH)3沉淀而与Cu2+分离,K2Cr2O7、NaClO、H2O2、KMnO4都具有氧化性,能将亚铁离子氧化,但是K2Cr2O7、NaClO、KMnO4能引进新的杂质离子,双氧水是绿色氧化剂,得到的还原产物是水,不会引进杂质离子, 所以答案是:C;(2)加入的物质Y可调节,使Fe3+全部沉淀,同时不引进新杂质,铁离子在水中存在水解平衡:Fe3++3H2OFe(OH)3+3H+ , 用Cu(OH)2、CuCO3、CuO、Cu2(OH)2CO3等,
中和溶液的酸性,能促进水解平衡向正反应方向移动,调节pH,可以将铁离子沉淀(Fe3+氢氧化物完全沉淀时的PH:3.2),同时引入铜离子,无新的金属离子引入,且铜离子不沉淀(Cu2+氢氧化物开始沉淀时的PH:4.7),氢氧化钠和氨气都能使铜离子沉淀,无法分离Fe3+、Cu2+ ,
所以答案是:AC;(3)结晶水合物,为防止结晶水散失,从溶液中获得晶体通常采用降温结晶,所以从溶液中获得氯化铜晶体(CuCl22H20)要经过蒸发浓缩、冷却结晶、过滤三步操作,
所以答案是:蒸发浓缩;冷却结晶;(4)KMnO4溶液具有强氧化性,能腐蚀碱式滴定管的胶管,所以选择酸式滴定管,测定溶液Ⅰ中Fe2+的浓度,用KMnO4标准溶液滴定,Fe2+与MnO4﹣反应,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,由电子守恒、电荷守恒、原子守恒可知,离子反应为MnO4﹣+5Fe2++8H+═Mn2++5Fe3++4H2O,
所以答案是:酸式;MnO4﹣+8H++5Fe2+=Mn2++5Fe3++4H2O.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案