题目内容
【题目】某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请根据如下实验方案回答问题. 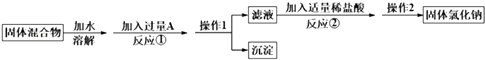
(1)A物质的化学式为;操作1的名称是 .
(2)反应①中加入略过量的A物质的目的是;判断A已过量的实验操作方法是 .
(3)写出反应②的化学方程式: . 如果加入盐酸过量,则对所得到的氯化钠的纯度(填“有”或“没有”)影响.
(4)实验时称取样品的质量为185.0g,经过操作1后,测得沉淀(不溶于水)的质量为50.0g,则样品中NaCl的质量分数是 .
【答案】
(1)Na2CO3;过滤
(2)保证钙离子沉淀完全;静置后取少量上层清液,滴加适量的稀盐酸,若有气体生成,则说明碳酸钠已过量
(3)Na2CO3+2HCl=2NaCl+CO2↑+H2O;没有
(4)70%
【解析】解:由分离流程可知,溶解后加过量的Na2CO3可除去氯化钙,操作①为过滤,得到沉淀为碳酸钙,滤液中含NaCl、Na2CO3 , 加适量盐酸,与碳酸钠反应,操作②为蒸发,最后得到NaCl,(1)由上述分析可知,A为Na2CO3 , 操作1的名称是过滤,所以答案是:Na2CO3;过滤;(2)反应①中加入略过量的A物质的目的是保证钙离子沉淀完全;判断A已过量的实验操作方法是静置后取少量上层清液,滴加适量的稀盐酸,若有气体生成,则说明碳酸钠已过量(或取上层清液少许继续滴加碳酸钠溶液无浑浊),
所以答案是:保证钙离子沉淀完全;静置后取少量上层清液,滴加适量的稀盐酸,若有气体生成,则说明碳酸钠已过量;(3)反应②的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O.因盐酸易挥发,如果加入盐酸过量,则对所得到的氯化钠的纯度没有影响,
所以答案是:Na2CO3+2HCl=2NaCl+CO2↑+H2O;(4)经过操作1后,测得沉淀(不溶于水)的质量为50.0g,则n(CaCl2)=n(CaCO3)= ![]() =0.5mol,则样品中NaCl的质量分数是
=0.5mol,则样品中NaCl的质量分数是 ![]() ×100%=70%,所以答案是:70%.
×100%=70%,所以答案是:70%.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl22H20),为制取纯净的CuCl22H20,首先将其制成水溶液,然后按如图步骤进行提纯: 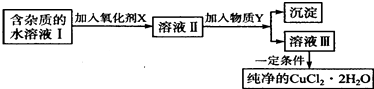
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
请回答下列问题.
(1)最适合作氧化剂X的是 .
A.K2Cr207
B.NaCl0
C.H202
D.KMn04
(2)加入的物质Y是 .
A.CuO
B.NaOH
C.Cu2(OH)2CO3
D.NH3
(3)由溶液Ⅲ获得CuCl22H2O,需要经过、、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用(“酸式”或“碱式”)滴定管.反应的化学方程式: .
【题目】铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl22H20),为制取纯净的CuCl22H20,首先将其制成水溶液,然后按如图步骤进行提纯: 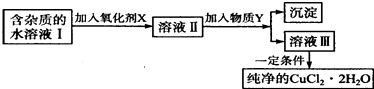
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
请回答下列问题.
(1)最适合作氧化剂X的是 .
A.K2Cr207
B.NaCl0
C.H202
D.KMn04
(2)加入的物质Y是 .
A.CuO
B.NaOH
C.Cu2(OH)2CO3
D.NH3
(3)由溶液Ⅲ获得CuCl22H2O,需要经过、、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用(“酸式”或“碱式”)滴定管.反应的化学方程式: .