题目内容
15.已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是( )(1)生成物的体积分数一定增加(2)生成物的产量一定增加(3)反应物的转化率一定增大(4)反应物浓度一定降低(5)正反应速率一定大于逆反应(6)加入催化剂.
| A. | (1)(2) | B. | (2)(5) | C. | (3)(5) | D. | (4)(6) |
分析 (1)对于正反应气体体积减少的反应,平衡向正反应移动,生成物的体积分数减小;
(2)平衡向正反应移动,生成物的产量一定增加;
(3)增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低;
(4)增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,浓度降低,自身增大;
(5)平衡向正反应移动,正反应速率一定大于逆反应速率;
(6)加入催化剂,正逆反应速率同等程度增大,平衡不移动.
解答 解:(1)对于正反应气体体积减少的反应,平衡向正反应移动,生成物的体积分数减小,故(1)错误;
(2)平衡向正反应移动,生成物的产量一定增加,但生成物的浓度不一定增大,故(2)正确;
(3)增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低,故(3)错误;
(4)增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,浓度降低,自身增大,故(4)错误;
(5)平衡向正反应移动,正反应速率一定大于逆反应速率,故(5)正确;
(6)加入催化剂,正逆反应速率同等程度增大,平衡不移动,故(6)错误.
综上所述(2)(5)正确.
故选B.
点评 本题考查化学平衡的影响因素,为高频考点,侧重考查学生的分析能力,题目难度中等,注意掌握影响化学平衡移动的因素,解答时注意从勒沙特列原理的角度分析.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 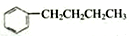 的与H2加成之后的产物中,其一氯代物有7种 的与H2加成之后的产物中,其一氯代物有7种 | |
| B. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| C. | 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. |  的一溴代物和 的一溴代物和  的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
6.下列各组的两种物质属于同素异形体的是( )
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | 红磷和白磷 | ||
| C. | 丁烷和异丁烷 | D. | ${\;}_{19}^{40}$K和${\;}_{20}^{40}$Ca |
3.下列说法正确的是( )
| A. | 室温时,某溶液的 pH小于7,则该溶质一定是酸或强酸弱碱盐 | |
| B. | 室温时,0.1mol•L-1 一元酸 HA的电离平衡常数为1×10-7,则该酸电离度约为0.1% | |
| C. | 浓度均为 0.01mol•L-1 的 CH3COOH 溶液和 CH3COONa 溶液等体积混合,混合溶液中:(CH3COO- )+c(CH3COOH)=0.02 mol?L-1 | |
| D. | 在温度不变的情况下,向MgCO3饱和溶液中加入Na2CO3溶液,MgCO3 将会析出,但Ksp不变 |
10.与卤素单质化学性质相似的物质称为拟卤素或类卤素,如氰气,它的结构式为N≡C-C≡N,下列说法不正确的是( )
| A. | 其中叁键的键长比单键要短 | |
| B. | 分子中含3个σ键和4个π键 | |
| C. | 分子构型为直线形 | |
| D. | 可以发生加成反应,但不能与氢氧化钠溶液反应 |
20.下列说法正确的是( )
| A. | 酸雨和温室效应都与化石燃料的使用有关 | |
| B. | 水体富营养化主要是因为水中含有较多的碳、氮等元素 | |
| C. | 天然气水合物,又称可燃冰,其主要可燃成分是氢气 | |
| D. | 聚酯纤维和光导纤维都是有机高分子材料 |
13.下列叙述正确的是( )
| A. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw不变 |
14.在一定温度下向一个体积为2L固定容积的密闭容器中充入一定量的N2O4,进行如下化学反应:N2O4(g)?2NO2(g),请回答下列问题:
(1)下列说法能够判断该反应已经达到化学平衡状态的是BD.
A.容器内混合气体密度不变
B.混合气体的压强不变
C.0.5molN2O4分解的同时有1molNO2生成
D.混合气体的颜色不变
(2)每隔一段时间对该密闭容器内的物质进行分析,得到如下数据:
①b的值为0.16;
②达到化学平衡状态时,N2O4的平衡转化率为42.9%(或42.86%);
③20s~40s内用N2O4表示该反应的平均反应速率υ(N2O4)=0.01mol•L-1•s-1.
(1)下列说法能够判断该反应已经达到化学平衡状态的是BD.
A.容器内混合气体密度不变
B.混合气体的压强不变
C.0.5molN2O4分解的同时有1molNO2生成
D.混合气体的颜色不变
(2)每隔一段时间对该密闭容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) (mol) | 2.80 | a | 2.00 | c | d | 1.60 |
| n(NO2) (mol) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
②达到化学平衡状态时,N2O4的平衡转化率为42.9%(或42.86%);
③20s~40s内用N2O4表示该反应的平均反应速率υ(N2O4)=0.01mol•L-1•s-1.
