题目内容
【题目】醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐(已知:25℃,Ka(CH3COOH)=1.69×10-5)。
(1)醋酸钠溶液呈碱性的原因是_______________(写出有关的离子方程式)
(2)在CH3COONa溶液中离子浓度由大到小的顺序为_____________________(用c(Bn+)表示相应离子浓度);
(3)25℃时,0.10mol/L的醋酸溶液的pH约为___________(已知:lg1.3=0.114);
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是____________;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小.
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解.
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离.
D.醋酸和醋酸钠混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离.
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是_______;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(6)常温时,有以下3种溶液,其中pH最小的是____________;
A.0.02molL-1CH3COOH与0.02molL-1NaOH溶液等体积混合液
B.0.03molL-1CH3COOH与0.01molL-1NaOH溶液等体积混合液
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液
(7)用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸钠溶液,则pH(CH3COONa)_______ pH(Na2CO3).(填:“>”、“<”或“=”)
【答案】 CH3COO+H2O CH3COOH+OH c(Na+)>c(CH3COO)>c(OH)>c(H+)或c(Na+)、c(CH3COO)、c(OH)、c(H+) 2.89或2.886 BC ABC C <
【解析】(1)醋酸钠是强碱弱酸盐,弱阴离子CH3COO-水解使溶液呈碱性,离子方程式为:CH3COO+H2O CH3COOH+OH。
(2)醋酸根离子水解,溶液显碱性,则c(Na+)>c(CH3COO)、c(OH)>c(H+),又因为一般水解是微弱的,所以c(Na+)和c(CH3COO)远大于c(OH)和c(H+),故CH3COONa溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO)>c(OH)>c(H+)或c(Na+)、c(CH3COO)、c(OH)、c(H+)。
(3)由已知,25℃时Ka(CH3COOH)=1.69×10-5,又因为Ka=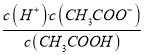 ,其中c(H+)=c(CH3COO-),c(CH3COOH)约为0.10mol/L,所以c(H+)=
,其中c(H+)=c(CH3COO-),c(CH3COOH)约为0.10mol/L,所以c(H+)=![]() =
=![]() =1.3×10-3mol/L,则pH=-lgc(H+)=3-lg1.3=2.886(或2.89)。
=1.3×10-3mol/L,则pH=-lgc(H+)=3-lg1.3=2.886(或2.89)。
(4)A项,稀释对电离和水解都有促进作用,则稀释时醋酸的电离程度增大,醋酸钠的水解程度增大,故A错误;B项,电离和水解均为吸热反应,所以升高温度,促进水解和电离,故B正确;C、D两项,醋酸电离是产生CH3COO,CH3COO水解是产生醋酸,二者作用相反,所以相互抑制,故C正确、D错误。
(5)因为25℃,Ka(CH3COOH)=1.69×10-5,所以Kh(CH3COO-)=![]() =
=![]() ,则Ka(CH3COOH)>Kh(CH3COO-),物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=2c(Na+)=2×(
,则Ka(CH3COOH)>Kh(CH3COO-),物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=2c(Na+)=2×(![]() ×0.1mol/L),由上述两个式子可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),综上分析A、B、C都正确。
×0.1mol/L),由上述两个式子可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),综上分析A、B、C都正确。
(6)A项,0.02molL-1CH3COOH与0.02molL-1NaOH溶液等体积混合,恰好生成醋酸钠,溶液显碱性;B项,0.03molL-1CH3COOH与0.01molL-1NaOH溶液等体积混合,得到醋酸和醋酸钠的混合溶液,剩余0.01mol/L醋酸;C项,pH=2的CH3COOH与pH=12的NaOH溶液等体积混合,得到醋酸和醋酸钠的混合溶液,
(7)弱酸酸性越强,对应的钠盐溶液中阴离子越容易水解,因为CH3COOH酸性强于HCO3-,所以0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸钠溶液中,水解程度:CO32->CH3COO,弱阴离子水解溶液显碱性,水解程度越大碱性越强,pH越大,则pH(CH3COONa)<pH(Na2CO3)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案