题目内容
【题目】可用以下方法处理尾气中的SO2。
方法一:活性炭还原法:
反应原理:恒温恒容2C(s)+2SO2(g)![]() S2(g)+2CO2(g)+Q
S2(g)+2CO2(g)+Q
反应进行到不同时间测得各物质的浓度如图:
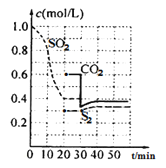
(1)第一次达到平衡的时间是第___min;0~20min化学反应速率表示v(SO2)=___。
(2)30min时平衡发生移动的条件是___。
(3)40min时,平衡常数的计算式为___。(指代入具体数值的算式)
方法二:亚硫酸钠吸收法
(4)Na2SO3溶液吸收SO2的离子方程式为___;
(5)如图是Na2SO3溶液中各离子浓度的相对大小关系示意图。
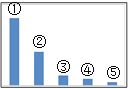
其中③是___。(填微粒符号)
常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是__(填序号)
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.水电离出c(OH一)=1×l0-8mol/L
【答案】20 0.03mol/(Lmin) 减小CO2的浓度 ![]() SO32-+SO2+H2O=2HSO3- OH- ac
SO32-+SO2+H2O=2HSO3- OH- ac
【解析】
(1)可逆反应达到平衡时,各组分的浓度保持不变;根据v=![]() 计算二氧化硫的速率;
计算二氧化硫的速率;
(2)30min瞬间,CO2浓度降低,S2的浓度不变,CO2、S2浓度增大,据此分析;
(3)40min的平衡常数和20min时相同,根据K= 计算平衡常数;
计算平衡常数;
(4)Na2SO3溶液与SO2反应生成亚硫酸氢钠;
(5)亚硫酸钠为强碱弱酸盐,SO32-水解使溶液显弱碱性,据此分析作答;
a. 根据电荷守恒判断;
b. 溶液可能是NaHSO3、Na2SO3混合溶液,根据物料守恒进行判断;
c. 水电离出H+的浓度等于溶液中OH-的浓度。
(1)从图中可知20min时各组分的浓度不变,此时反应达到平衡状态;0-20min时,SO2的浓度从1.0mol/L变为0.4mol/L,变化量为0.6mol/L,因此v(SO2)=![]() =
=![]() =0.03mol/(Lmin);
=0.03mol/(Lmin);
(2)30min瞬间,CO2浓度降低,S2的浓度不变,CO2、S2浓度增大,应是减小CO2的浓度形成的;
(3)40min的平衡常数和20min时相同,20min时,SO2的浓度为0.4mol/L,S2的浓度为0.3mol/L,CO2的浓度为0.6mol/L,因此平衡常数K= =
=![]() ;
;
(4)Na2SO3溶液与SO2反应生成亚硫酸氢钠,离子方程式为:SO32-+SO2+H2O=2HSO3-;
(5)亚硫酸钠完全电离生成Na+和SO32-,而SO32-水解生成HSO3-,且HSO3-能继续水解生成H2SO3,最终使溶液呈弱碱性,即c(OH-)>c(H+),因此Na2SO3溶液中各离子浓度的相对大小关系为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),因此图中③是OH-;
a. 根据电荷守恒知:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),因此溶液中c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),a项正确;
b. 当溶质为NaHSO3时,溶液中S元素以SO32-、HSO3-、H2SO3的形式存在,Na元素与S元素的物质的量之比为1:1,因此溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),若溶液中存在Na2SO3,则c(Na+)>c(SO32-)+c(HSO3-)+c(H2SO3),b项错误;
c. 水电离出H+的浓度等于溶液中OH-的浓度,由于pH=6,那么水电离出的c(OH-)=![]() =10-8mol/L,c项正确;
=10-8mol/L,c项正确;
答案选ac。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
【题目】下图是古丝绸之路中的重要贸易商品,下列有关说法错误的是
|
|
|
|
瓷器 | 丝绸 | 茶叶 | 酒 |
A.陶瓷由黏土经高温烧结而成,其主要成分是硅酸盐
B.丝绸的化学成分主要是纤维素,纤维素属于天然有机高分子化合物
C.茶叶中含多种酚类物质,经常饮用可抗氧化、防衰老
D.我国劳动人民很早就掌握了酿酒技术,但自酿酒中可能会含有甲醇等有害物质,不建议直接饮用