题目内容
【题目】捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。许多科学家认为从空气中捕获二氧化碳不仅在理论上可行,很快还会成为一个对付全球变暖的实用武器;目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.HOCH2CH2NH2 C.CH3CH2OH D.NH4Cl
(2)工业上用NH3捕碳可合成CO (NH2)2:
已知:①标准状况下,11.2L NH3与足量CO2完全反应生成NH2CO2 NH4 (s)时放出39.8kJ的热量;②NH2CO2 NH4 (s)= CO(NH2)2(s)+ H2O(g) △H=+72.5 KJ·mol-1。
则2NH3(g)+CO2(g)=CO(NH2)2(s)+ H2O(g)的△H=_____________KJ·mol-1。
(3)用(NH4)2CO3捕碳的反应如下:
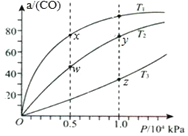
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:

①c点的逆反应速率和d点的正反应速率的大小关系为V逆c _____V正d (填“>”、“=”或“<”)
②b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为 _____________。(填“>”、“=”或“<”)
③在T2~T4温度区间,容器内CO2气体浓度呈现先减小后增大的变化趋势,其原因是________。
(4)用碱性溶液也可捕碳:在常温下,将0.04mol CO2通入200mL 0.2mol/L的Na2S溶液中,已知: H2CO3的电离平衡常数:K1=4.3×10—7、K2=5.6×10—11;H2S的电离平衡常数:K1=5.0×10—8、K2=1.1×10—12。回答下列问题
①发生反应的离子方程式为_____________________________
②充分反应后下列关系式中正确的是_____________________
A.(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
B.c(CO32-)+ c(HCO3-)+ c(H2CO3)>c(H2S)+c(HS-)+c(S2-)
C.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
③计算反应后的溶液中c(H2S).c(OH-)/c(HS-)的值为______________
【答案】C D -86.7 < K b>K c>Kd T2-T3区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高。T3-T4区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获 CO2+S2—+H2O=HCO3—+HS— C 2×10—7
【解析】
(1)二氧化碳是酸性氧化物,能够与碱性的物质发生反应;
(2)根据盖斯定律进行计算;
(3)①温度高反应速率快,据此分析c点的逆反应速率和d点的正反应速率的大小关系;
②该反应正反应为放热反应,温度升高,平衡左移,平衡常数减小,据此进行分析;
③T2-T3区间,化学反应未达到平衡,温度越高,化学反应的速率越快;T3-T4区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获;据此进行分析。
(4)①根据电离平衡常数可知酸性由大到小顺序:H2CO3>H2S>HCO3->HS-,根据强酸制备弱酸规律,分析该反应的产物;
②充分反应后所得溶液为碳酸氢钠和硫氢化钠;根据物料守恒、电荷守恒进行分析,根据两种酸式盐水解的能力进行分析;
③c(H2S)×c(OH-)/c(HS-)=c(H2S)×c(OH-)×c(H+)/c(HS-)c(H+)=KW/Ka1,据此进行计算。
(1)二氧化碳是酸性氧化物,具有碱性的物质均能捕获CO2,反应如下: Na2CO3+CO2+H2O=2NaHCO3, HOCH2CH2NH2+CO2+H2O= HOCH2CH2NH3++ HCO3-;而CH3CH2OH显中性,NH4Cl溶液显酸性均不与CO2反应,不能做CO2捕获剂;
因此,本题正确答案是: C D。
(2)①标准状况下,11.2L NH3的物质的量为0.5mol,与足量CO2完全反应生成NH2CO2 NH4 (s)时放出39.8kJ的热量,则2NH3(g)+CO2(g)=NH2CO2 NH4 (s),△H=-39.8×4=-159.2KJ·mol-1;②NH2CO2 NH4 (s)= CO(NH2)2(s)+ H2O(g) △H=+72.5 KJ·mol-1。
根据盖斯定律可知:①+②可得2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-159.2KJ·mol-1+72.5KJ·mol-1=-86.7KJ·mol-1。
综上所述。本题答案是:-86.7。
(3)①针对于同一个反应来讲,温度高反应速率快,d点温度大于c点的温度,所以c点的逆反应速率和d点的正反应速率的大小关系为V逆c <V正d;
综上所述,本题答案是:<。
②在图1中CO2的浓度存在一最低点,则在T1~T2区间,反应未达到化学平衡,温度升高,反应速率加快,CO2被捕捉的量增加,剩余CO2的浓度减小;T4~T5区间,反应已达到化学平衡,升高温度剩余CO2的浓度增大,即升高温度,反应平衡向左移动,因此正反应为放热反应,即ΔH3<0,所以温度升高,平衡常数减小,因此b、c、d三点的平衡常数K b 、K c、Kd 从大到小的顺序为 K b>K c>Kd;
综上所述,本题答案是; K b>K c>Kd。
③T2-T3区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高。T3-T4区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获;所以在T2~T4温度区间,容器内CO2气体浓度呈现先减小后增大的变化趋势;
综上所述,本题答案是:T2-T3区间,化学反应未达到平衡,温度越高,化学反应的速率越快,所以CO2被捕获的量随温度升高而提高。T3-T4区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获。
(4)①根据电离平衡常数可知,酸性大小顺序:H2CO3>H2S>HCO3->HS-,所以将0.04molCO2通入200mL0.2mol/L的Na2S溶液中,n(CO2):n(Na2S)=1:1反应生成碳酸氢钠和硫氢化钠,发生反应的离子方程式为CO2+S2—+H2O=HCO3—+HS—;
综上所述,本题答案是:CO2+S2—+H2O=HCO3—+HS—;
②据①分析可知,充分反应后所得溶液为碳酸氢钠和硫氢化钠,
B.同浓度的同体积的碳酸氢钠和硫氢化钠,二者溶质的物质的量相等,因此根据物料守恒可知:c(CO32-)+c(HCO3-)+c(H2CO3)=c(H2S)+c(HS-)+c(S2-),B错误;
C.碳酸氢钠溶液的Kh=KW/Ka1=10-14/4.3×10-7=1/4.3×10-7;硫氢化钠溶液的Kh=KW/Ka1=10-14/5.0×10—8=1/5×10-6,碳酸氢钠溶液的水解能力小于硫氢化钠溶液的水解能力,所以c(Na+)>c(HCO3-)>c(HS-)>c(OH-);C正确;
综上所述,本题答案是:C。
③c(H2S)×c(OH-)/c(HS-)=c(H2S)×c(OH-)×c(H+)/c(HS-)c(H+)=KW/Ka1=10-14/5.0×10-8=1/5×10—6=2×10-7;
综上所述,本题答案是:2×10-7。

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案