��Ŀ����
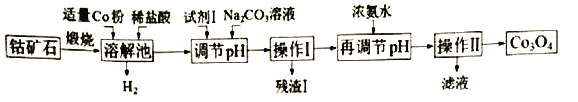
����Ŀ������֪t��ʱAgCI��Ksp��2��10��10������t��ʱAg2CrO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ����

A����t��ʱ��Ag2CrO4��KspΪ1��10��9
B���ڱ���Ag2CrO4��Һ�м���K2CrO4��ʹ��Һ��Y�㵽X��
C����t��ʱ����0.01 mol/LAgNO3��Һ�ζ�20 mL 0.01 mol/L KCI��0.01 mol/L��K2CrO4�Ļ����Һ��CrO42���ȳ���
D����t��ʱ����ӦAg2CrO4(s)��2Cl��(aq)![]() 2AgCl(s)��CrO42��(aq)��ƽ�ⳣ��K��2.5��107
2AgCl(s)��CrO42��(aq)��ƽ�ⳣ��K��2.5��107
���𰸡�D
��������
���������A������ͼ�������ϵ����ݽ���ܶȻ������������õ��������ϵĵ��dz����ܽ�ƽ�⣬Ag2CrO4�ij����ܼ�ƽ��Ϊ��Ag2CrO4��s��![]() 2Ag+CrO42-��Ksp��c2��Ag+��c��CrO42-������10-3��2��10-6��10-12����A����B���ڱ���Ag2CrO4��Һ�м���K2CrO4��Ϊ������Һ�������������ϣ������ڱ���Ag2CrO4��Һ�м���K2CrO4����ʹ��Һ��Y���ΪX�㣬��B����C�������ܶȻ���������Ksp��CrO42-��=c2��Ag+��c��CrO42-��=1��10-12��Ksp��AgCl��=c��Ag+��c��Cl-��=1.8��10-10����0.01mol/L AgNO3��Һ�ζ�20mL0.01mol/L KCl��0.01mol/L��K2CrO4�Ļ����Һ��c��CrO42-��=0.01mol/L���õ�c��Ag+����10��12��0.01��10-5mol/L��0.01mol/L KCl��Һ�У�c��Cl-����0.01mol/L�������ܶȻ�����õ���c��Ag+����2��1010��0.01��2��10-8mol/L�������������Ȼ�����������C������D����t��ʱ����ӦAg2CrO4(s)��2Cl��(aq)
2Ag+CrO42-��Ksp��c2��Ag+��c��CrO42-������10-3��2��10-6��10-12����A����B���ڱ���Ag2CrO4��Һ�м���K2CrO4��Ϊ������Һ�������������ϣ������ڱ���Ag2CrO4��Һ�м���K2CrO4����ʹ��Һ��Y���ΪX�㣬��B����C�������ܶȻ���������Ksp��CrO42-��=c2��Ag+��c��CrO42-��=1��10-12��Ksp��AgCl��=c��Ag+��c��Cl-��=1.8��10-10����0.01mol/L AgNO3��Һ�ζ�20mL0.01mol/L KCl��0.01mol/L��K2CrO4�Ļ����Һ��c��CrO42-��=0.01mol/L���õ�c��Ag+����10��12��0.01��10-5mol/L��0.01mol/L KCl��Һ�У�c��Cl-����0.01mol/L�������ܶȻ�����õ���c��Ag+����2��1010��0.01��2��10-8mol/L�������������Ȼ�����������C������D����t��ʱ����ӦAg2CrO4(s)��2Cl��(aq)![]() 2AgCl(s)��CrO42��(aq)��ƽ�ⳣ��
2AgCl(s)��CrO42��(aq)��ƽ�ⳣ��![]() ��2.5��107����D��ȷ����ѡD��
��2.5��107����D��ȷ����ѡD��

 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�