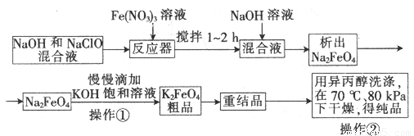
题目内容
下列离子反应方程式正确的是
- A.澄清石灰水来吸收氯气:Cl2+OH-=Cl-+ClO-+H+
- B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
- C.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
- D.在碳酸氢钙溶液中加入少量苛性钾溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B
解析:
分析:A、澄清石灰水来吸收氯气的产物是两种盐和水;
B、钠和水剧烈反应放氢气同时生成氢氧化钠;
C、铁能被硝酸氧化为三价铁;
D、在碳酸氢钙溶液中加入少量苛性钾溶液时,碳酸氢钙有剩余.
解答:A、氯气和强碱反应的实质是:Cl2+2OH-=Cl-+ClO-+H2O,故A错误;
B、钠和水剧烈反应放氢气同时生成氢氧化钠,即2Na+2H2O=2Na++2OH-+H2↑,故B正确;
C、向稀硝酸中加入少量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O,故C错误;
D、在碳酸氢钙溶液中加入少量苛性钾溶液,反应为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故D错误.故选B.
点评:本题目考查学生离子方程式的书写和正误的判断方法,是现在考试的热点,难度不大.
解析:
分析:A、澄清石灰水来吸收氯气的产物是两种盐和水;
B、钠和水剧烈反应放氢气同时生成氢氧化钠;
C、铁能被硝酸氧化为三价铁;
D、在碳酸氢钙溶液中加入少量苛性钾溶液时,碳酸氢钙有剩余.
解答:A、氯气和强碱反应的实质是:Cl2+2OH-=Cl-+ClO-+H2O,故A错误;
B、钠和水剧烈反应放氢气同时生成氢氧化钠,即2Na+2H2O=2Na++2OH-+H2↑,故B正确;
C、向稀硝酸中加入少量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O,故C错误;
D、在碳酸氢钙溶液中加入少量苛性钾溶液,反应为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故D错误.故选B.
点评:本题目考查学生离子方程式的书写和正误的判断方法,是现在考试的热点,难度不大.

练习册系列答案
相关题目
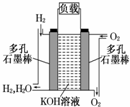 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: .
.
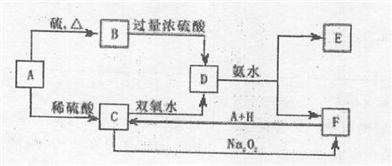
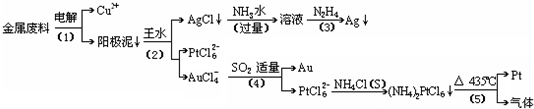
 2Ag+4NH3+CH2OH(CHOH)4COOH+H2O
2Ag+4NH3+CH2OH(CHOH)4COOH+H2O