题目内容
【题目】下列有关常数表达式的正确的是( )。
A.NH3·H2O ![]() NH4+ + OH-Ka =
NH4+ + OH-Ka =
B.CH3CH2COO - + H2O![]() CH3CH2COOH +OH- Kh =
CH3CH2COOH +OH- Kh = 
C.AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp = c(Ag+)c(Cl-)
Ag+(aq)+Cl-(aq) Ksp = c(Ag+)c(Cl-)
D.FeO(s)+CO(g) ![]() Fe(s)+CO2(g) K =
Fe(s)+CO2(g) K =![]()
【答案】C
【解析】
A. NH3·H2O ![]() NH4+ + OH-,NH3·H2O是弱碱,电离平衡常数常用Kb表示,Kb =
NH4+ + OH-,NH3·H2O是弱碱,电离平衡常数常用Kb表示,Kb = ,故A错误;
,故A错误;
B. 水为纯液体,平衡常数表达式中不写入,CH3CH2COO - + H2O![]() CH3CH2COOH +OH- Kh =
CH3CH2COOH +OH- Kh = 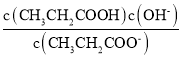 ,故B错误;
,故B错误;
C. AgCl(s) ![]() Ag+(aq)+Cl-(aq) ,AgCl的容度积,AgCl是固体,不写入, Ksp = c(Ag+)c(Cl-),故C正确;
Ag+(aq)+Cl-(aq) ,AgCl的容度积,AgCl是固体,不写入, Ksp = c(Ag+)c(Cl-),故C正确;
D. 反应中FeO(s)、Fe(s)为固体,FeO(s)+CO(g) ![]() Fe(s)+CO2(g) 平衡常数为 K =
Fe(s)+CO2(g) 平衡常数为 K =![]() ,故D错误;
,故D错误;
故选C。

 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是_________________________________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________________________(填一种方法即可)。
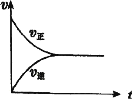
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
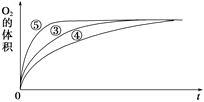
分析该图能够得出的实验结论是________________________________。
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。
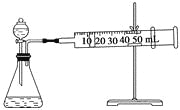
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_______或______来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:_____________。请计算H2O2的初始物质的量浓度为________________(保留两位有效数字)。
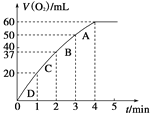
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):/span>a._________________;b.___________________。
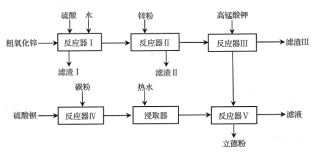
【题目】NiCl2是化工合成中最重要的镍源。工业上利用含镍(Ni)废催化剂(主要含有Ni,还含有SiO2、Al2O3、Fe及其它不溶于酸、碱的杂质)生产氯化镍晶体(NiCl2·nH2O)流程如下:
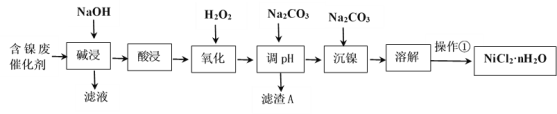
部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列问题:
(1)Ni的原子序数为28,位于元素周期表第四周期,最外层电子数为2,则其原子结构示意图为________________。
(2)“酸浸”、“溶解”所使用的酸为_____________。“碱浸”时发生反应的离子方程式为SiO2+2OH-=SiO32-+H2O、___________________。
(3)“氧化”加入H2O2溶液,其作用是____________________(用离子方程式表示)。然后调节pH使溶液中铁元素恰好完全沉淀(离子浓度≤10-5mol·L-1时,离子沉淀完全),此时常温下的pH约为____________。
(4)“操作①”的实验操作依次为缓缓加热,浓缩至_________________________为止、冷却结晶、过滤、洗涤、干燥,即得产品。
(5)为了测定NiCl2nH2O中结晶水数目进行如下实验:取23.8 g样品在一定条件下脱水得13.0 g NiCl2,则n=__________。
(6)镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式__________________。
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式__________________。