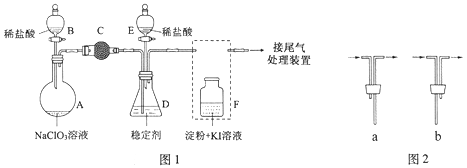
题目内容
【题目】在1.5L的密闭容器中通入2molX2和3molY2的混合气体,在一定条件下发生反应:X2(g)+3Y2(g) ![]() 2Z(g) +4W(?) ΔH<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量)。
2Z(g) +4W(?) ΔH<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量)。
(1)该反应的化学平衡常数值为_______
(2)为提高X2的平衡转化率,下列措施可行的是___________
a.向体系中再通入一定量的X2
b.降温
c.移出部分Z
d.再冲入一定量Ar e.增大容器体积
(3)反应达平衡后,t1时刻改变条件,速率随时间变化如图所示,则t1对应条件改变为_______

a. 升温
b. 向体系中再通入一定量的W
c. 移走部分X2、Y2
d.减小容器的体积
【答案】0.44 bc a
【解析】
(1)容器内压强为反应开始时的0.8(相同温度下测量),说明反应前后气体压强减小,气体物质的量减小,则W不是气体,由题给数据建立三段式求解;
(2)反应是气体体积减小的放热反应,为提高X2的平衡转化率,平衡向正反应方向移动;
(3)反应达平衡后,t1时刻改变条件依据图象变化可知,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆反应方向移动。
(1)容器内压强为反应开始时的0.8(相同温度下测量),说明反应前后气体压强减小,气体物质的量减小,则W不是气体,在1.5L的密闭容器中通入2molX2和3molY2的混合气体,容器内压强为反应开始时的0.8,设反应的X2物质的量为x,由题意建立如下三段式:
X2(g)+3Y2(g)![]() 2Z(g)+4W(?)
2Z(g)+4W(?)
起始量(mol) 2 3 0
变化量(mol) x 3x 2x
平衡量(mol) 2-x 3-3x 2x
由![]() 可得,关系式(2-x+3-3x+2x)=(2+3)×0.8,解得x=0.5mol,平衡时c(X2)=
可得,关系式(2-x+3-3x+2x)=(2+3)×0.8,解得x=0.5mol,平衡时c(X2)=![]() =1mol/L,c(Y2)=
=1mol/L,c(Y2)=![]() =1mol/L,c(Z)=
=1mol/L,c(Z)=![]() =
=![]() mol/L,则平衡常数K=
mol/L,则平衡常数K=![]() =
=![]() ≈0.44,故答案为:0.44;
≈0.44,故答案为:0.44;
(2)a、向体系中再通入一定量的X2,增大反应物浓度,平衡向正反应方向移动,但X2转化率减小,故错误;
b、该反应是放热反应,降低温度,平衡向正反应方向移动,X2转化率增大,故正确;
c、移出部分Z,减小生成物浓度,平衡向正反应方向移动X2转化率增大,故正确;
d、恒温恒容容器中再冲入一定量Ar,总压增大分压不变,平衡不变,X2转化率不变,故错误;
e、增大容器体积,压强减小,平衡向气体体积增大的方向进行,平衡向逆反应方向移动,X2转化率减小,故e错误;
bc正确,故答案为:bc;
(3)a、该反应是放热反应,升高温度,正、逆反应速率均增大,平衡向逆反应方向移动,故正确;
b、W不是气体,向体系中再通入一定量的W,对化学平衡无影响,故错误;
c、移走部分X2、Y2,平衡向逆反应方向移动,但反应速率减小,故错误;
d、减小容器的体积,压强增大,反应速率增大,平衡向气体体积减小的正反应方向移动,故错误;
a正确,故答案为:a。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】(1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:
实验序号 | 金属质量/g | 金属状态 | c(H2SO4)/molL-1 | V(H2SO4)/mL | 反应前溶液温度/℃ | 金属消失的时间/s |
1 | 0.10 | 丝 | 0.5 | 50 | 20 | 500 |
2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 50 |
3 | 0.10 | 丝 | 1.0 | 50 | 20 | 125 |
4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 |
对比实验1和3,表明影响化学反应速率的因素是___;此外,该实验表明影响化学反应速率的因素还有___。
(2)用如图原电池装置可加快铁与稀硫酸反应的速率,其中铜作___(填“负极”或“正极”),铁的电极反应式是___。

(3)举出生活中你熟悉的一种二次电池___。
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大___min(填0~1、1~2、2~3、3~4、4~5),原因是____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是(________)
A.蒸馏水
B.KCl溶液
C.KNO3溶液
D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
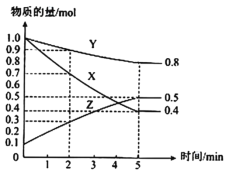
①该反应的化学方程式是___。
②该反应达到平衡状态的标志是___。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1molY的同时生成2molZ
③2min内X的转化率为___。
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D