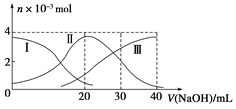
ЬтФПФкШн
ЁОЬтФПЁПЃЈ1ЃЉвбжЊЃКЗДгІFe(s)ЃЋCO2(g)![]() FeO(s)ЃЋCO(g)ЕФЦНКтГЃЪ§ЮЊK1ЃЛЗДгІFe(s)ЃЋH2O(g)
FeO(s)ЃЋCO(g)ЕФЦНКтГЃЪ§ЮЊK1ЃЛЗДгІFe(s)ЃЋH2O(g)![]() FeO(s)ЃЋH2(g)ЕФЦНКтГЃЪ§ЮЊK2ЁЃВЛЭЌЮТЖШЪБK1ЁЂK2ЕФжЕШчЯТБэЃК
FeO(s)ЃЋH2(g)ЕФЦНКтГЃЪ§ЮЊK2ЁЃВЛЭЌЮТЖШЪБK1ЁЂK2ЕФжЕШчЯТБэЃК
ЮТЖШ/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
ЂйдђЗДгІCO2(g)ЃЋH2(g)![]() CO(g)ЃЋH2O(g)ЕФЦНКтГЃЪ§KПЩБэЪОЮЊKЃН__(гУK1гыK2РДБэЪО)
CO(g)ЃЋH2O(g)ЕФЦНКтГЃЪ§KПЩБэЪОЮЊKЃН__(гУK1гыK2РДБэЪО)
ЂкИљОнБэжаЪ§ОнЃЌПЩЭЦжЊИУЗДгІCO2(g)ЃЋH2(g)![]() CO(g)ЃЋH2O(g)ЪЧ__(ЬюЁАЮќШШЁБЛђЁАЗХШШЁБ)ЗДгІЁЃ
CO(g)ЃЋH2O(g)ЪЧ__(ЬюЁАЮќШШЁБЛђЁАЗХШШЁБ)ЗДгІЁЃ
ЃЈ2ЃЉвбжЊдкЮТЖШЮЊTЪБЃЌCO(g)ЃЋH2O(g)![]() CO2(g)ЃЋH2(g)ЕФЦНКтГЃЪ§KЃН0.32ЃЌдкИУЮТЖШЯТЃЌвбжЊcЪМ(CO)ЃН1molЁЄLЃ1ЃЌcЪМ(H2O)ЃН1molЁЄLЃ1ЃЌФГЪБПЬОВтЖЈCOЕФзЊЛЏТЪЮЊ20%ЃЌдђДЫЪБИУЗДгІ__(ЬюЁАДяЕНЦНКтЁБЛђЁАЯђгввЦЖЏЁБЛђЁАЯђзѓвЦЖЏЁБ)ЃЌРэгЩЪЧ__(ЭЈЙ§МЦЫуЫЕУїРэгЩ)ЁЃ
CO2(g)ЃЋH2(g)ЕФЦНКтГЃЪ§KЃН0.32ЃЌдкИУЮТЖШЯТЃЌвбжЊcЪМ(CO)ЃН1molЁЄLЃ1ЃЌcЪМ(H2O)ЃН1molЁЄLЃ1ЃЌФГЪБПЬОВтЖЈCOЕФзЊЛЏТЪЮЊ20%ЃЌдђДЫЪБИУЗДгІ__(ЬюЁАДяЕНЦНКтЁБЛђЁАЯђгввЦЖЏЁБЛђЁАЯђзѓвЦЖЏЁБ)ЃЌРэгЩЪЧ__(ЭЈЙ§МЦЫуЫЕУїРэгЩ)ЁЃ
ЃЈ3ЃЉдкШнЛ§ЮЊVLЕФШнЦїжаГфШыamolCOгы2amolH2ЃЌдкДпЛЏМСзїгУЯТЗДгІЩњГЩМзДМЃЌЦНКтЪБCOЕФзЊЛЏТЪгыЮТЖШЁЂбЙЧПЕФЙиЯЕШчЭМЫљЪОЁЃ
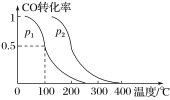
Ђйp1__(ЬюЁАДѓгкЁБЁАаЁгкЁБЛђЁАЕШгкЁБ)p2ЁЃ
ЂкдкЦфЫћЬѕМўВЛБфЕФЧщПіЯТЃЌдйдіМгamolCOгы2amolH2ЃЌДяЕНаТЦНКтЪБЃЌCOЕФзЊЛЏТЪ__(ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБЃЌЯТЭЌ)ЃЌЦНКтГЃЪ§__ЁЃ
ЁОД№АИЁП![]() ЮќШШ ЯђгввЦЖЏ ДЫЪБQc=
ЮќШШ ЯђгввЦЖЏ ДЫЪБQc=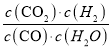 ЃН
ЃН![]() =0.0625ЃМ0.32 аЁгк діДѓ ВЛБф
=0.0625ЃМ0.32 аЁгк діДѓ ВЛБф
ЁОНтЮіЁП
гЩБэжаЪ§ОнПЩжЊЃЌЮТЖШЩ§ИпЃЌЗДгІЂйFe(s)ЃЋCO2(g)![]() FeO(s)ЃЋCO(g)ЕФЦНКтГЃЪ§діДѓЃЌЫЕУїЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌдђе§ЗДгІЮќШШЃЌЗДгІЂкFe(s)ЃЋH2O(g)
FeO(s)ЃЋCO(g)ЕФЦНКтГЃЪ§діДѓЃЌЫЕУїЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌдђе§ЗДгІЮќШШЃЌЗДгІЂкFe(s)ЃЋH2O(g)![]() FeO(s)ЃЋH2(g) ЦНКтГЃЪ§МѕаЁЃЌЫЕУїЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌдђе§ЗДгІЗХШШЁЃ
FeO(s)ЃЋH2(g) ЦНКтГЃЪ§МѕаЁЃЌЫЕУїЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌдђе§ЗДгІЗХШШЁЃ
ЯрЭЌЮТЖШЯТЃЌЭЌвЛШнЦїжаЃЌдіДѓбЙЧПЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌдђCOЕФзЊЛЏТЪдіДѓЃЛЮТЖШШнЛ§ВЛБфЃЌЯђИУУмБеШнЦїдйдіМгa mol COгы 2a mol H2ЃЌЕШаЇЮЊПЊЪММгШы2a mol COгы 4a mol H2ЃЌЬхЛ§РЉДѓ1БЖЃЌЦНКтКѓдіДѓбЙЧПЃЌдйбЙЫѕЛжИДЕНдРДЬхЛ§ЃЌдіДѓбЙЧПЦНКтЯђЬхЛ§МѕаЁЕФЗНЯђвЦЖЏЃЛЦНКтГЃЪ§жЛЪмЮТЖШгАЯьЃЌЮТЖШВЛБфЃЌЦНКтГЃЪ§ВЛБфЃЌИњОнДЫЗжЮіНтД№ЁЃ
ЃЈ1ЃЉвбжЊЗДгІЂйFe(s)ЃЋCO2(g)![]() FeO(s)ЃЋCO(g)ЕФЦНКтГЃЪ§ЮЊK1ЃЛЗДгІЂкFe(s)ЃЋH2O(g)
FeO(s)ЃЋCO(g)ЕФЦНКтГЃЪ§ЮЊK1ЃЛЗДгІЂкFe(s)ЃЋH2O(g)![]() FeO(s)ЃЋH2(g)ЕФЦНКтГЃЪ§ЮЊK2ЃЌИљОнИЧЫЙЖЈТЩЂй-ЂкЕУCO2(g)ЃЋH2(g)
FeO(s)ЃЋH2(g)ЕФЦНКтГЃЪ§ЮЊK2ЃЌИљОнИЧЫЙЖЈТЩЂй-ЂкЕУCO2(g)ЃЋH2(g)![]() CO(g)ЃЋH2O(g)ЃЌЦфЦНКтГЃЪ§KПЩБэЪОЮЊKЃН
CO(g)ЃЋH2O(g)ЃЌЦфЦНКтГЃЪ§KПЩБэЪОЮЊKЃН![]() ЁЃгЩЬтвтПЩЕУ973KЪБK3=1.47ЁТ2.38=0.62ЃЌ1173KЪБK3=2.15ЁТ1.67=1.29ЃЌЫцзХЮТЖШЕФЩ§ИпЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌе§ЗДгІЮќШШЁЃ
ЁЃгЩЬтвтПЩЕУ973KЪБK3=1.47ЁТ2.38=0.62ЃЌ1173KЪБK3=2.15ЁТ1.67=1.29ЃЌЫцзХЮТЖШЕФЩ§ИпЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌе§ЗДгІЮќШШЁЃ
ЙЪД№АИЮЊ![]() ЮќШШЁЃ
ЮќШШЁЃ
ЃЈ2ЃЉвбжЊcЪМ(CO)ЃН1molЁЄLЃ1ЃЌcЪМ(H2O)ЃН1molЁЄLЃ1ЃЌФГЪБПЬОВтЖЈCOЕФзЊЛЏТЪЮЊ20%ЃЌдђДЫЪБИУЗДгІQc=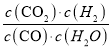 ЃН
ЃН![]() =0.0625ЃМ0.32ЃЌQcЃМKЪБЗДгІЯђе§ЗДгІЗНЯђНјааЁЃ
=0.0625ЃМ0.32ЃЌQcЃМKЪБЗДгІЯђе§ЗДгІЗНЯђНјааЁЃ
ЙЪД№АИЮЊЃКЯђгввЦЖЏ Qc=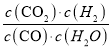 ЃН
ЃН![]() =0.0625ЃМ0.32
=0.0625ЃМ0.32
ЃЈ3ЃЉЂйЯрЭЌЮТЖШЯТЃЌЭЌвЛШнЦїжаЃЌдіДѓбЙЧПЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌдђCOЕФзЊЛЏТЪдіДѓЃЌИљОнЭМЯѓжЊЃЌp1аЁгкp2ЁЃ
ЂкЮТЖШШнЛ§ВЛБфЃЌЯђИУУмБеШнЦїдйдіМгa mol COгы 2a mol H2ЃЌЕШаЇЮЊПЊЪММгШы2a mol COгы 4a mol H2ЃЌЬхЛ§РЉДѓ1БЖЃЌЦНКтКѓдіДѓбЙЧПЃЌдйбЙЫѕЛжИДЕНдРДЬхЛ§ЃЌдіДѓбЙЧПЦНКтЯђЬхЛ§МѕаЁЕФЗНЯђвЦЖЏЁЃИУЗДгІЮЊЦјЬхЬхЛ§МѕаЁЕФЗДгІЃЌЙЪЯђе§ЗДгІвЦЖЏЃЌCOзЊЛЏТЪдіДѓЁЃЦНКтГЃЪ§жЛЪмЮТЖШгАЯьЃЌЮТЖШВЛБфЃЌЦНКтГЃЪ§ВЛБфЁЃ
ЙЪД№АИЮЊЃКаЁгк діДѓ ВЛБф

 Ек1ОэЕЅдЊдТПМЦкжаЦкФЉЯЕСаД№АИ
Ек1ОэЕЅдЊдТПМЦкжаЦкФЉЯЕСаД№АИ