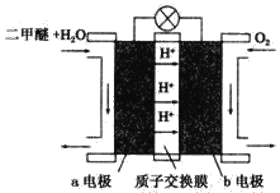
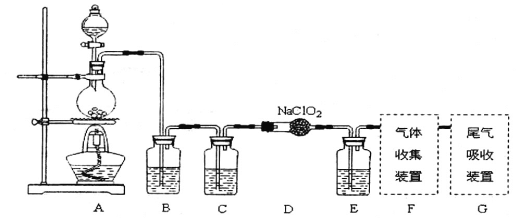
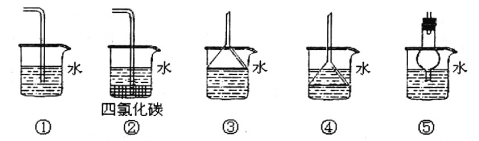
题目内容
【题目】一定温度下在容积为2 L的密闭容器内进行某一反应,容器内气体X、气体Y的物质的量随反应时间变化的曲线如图所示。据图可知

A. 反应的化学方程式为4Y=X
B. 反应进行到t1时,Y的浓度减少了3 mol·L-1
C. 反应进行到t2时,达到平衡状态
D. 反应进行到t3时,每生成4 mol Y的同时生成1 mol X
【答案】D
【解析】
A.t3时达到平衡状态,0~t1时间段内Y的物质的量减少10mol-6mol=4mol,X的物质的量增加3mol-2mol=1mol,反应的方程式为4YX,且反应为可逆反应,故A错误;
B.反应进行到t1时,Y的物质的量为6mol,物质的量的变化量为10mol-6mol=4mol,则浓度的变化量为4mol/2L=2mol/L,故B错误;
C.反应进行到t2时,反应物和生成物的物质的量仍在变化,反应没有达到平衡状态,故C错误;
D.根据A选项的分析,此反应的方程式为4YX,则反应进行到t3时,反应达到平衡状态,正反应速率和逆反应速率相等,则每生成4 mol Y的同时生成1 mol X,故D正确。答案选D。

【题目】利用下图图装置测定中和热的实验步骤如下:
| ①用量筒量取50 mL 0.50mol·L-l盐酸倒入小烧杯中,测出盐酸温度; ②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度; ③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。 |
回答下列问题:
(1)倒入NaOH溶液的正确操作是______________。
A.沿玻璃缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是______________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)做了三次实验,每次取溶液各50 mL,并将实验数据记录如下:

已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4. 2×10-3kJ/(g·℃),则该反应的中和热△H=____________________________。
(4)若用50 mL 0.55 mol·L-1的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H的绝对值会___________(填“偏小”、“偏大”或“不变”)。
(5)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是______________。
A.实验装置保温、隔热效果差
B.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
C.量取NaOH溶液的体积时仰视读数
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D