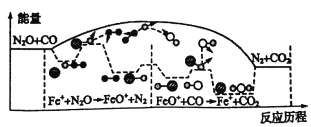
题目内容
【题目】常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2AⅡ代表HA-Ⅲ代表A2-)根据图示判断下列说法正确的是( )
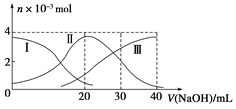
A.H2A在水中的电离方程式是:H2A=H++HA-、HA-H++A2-
B.当V(NaOH)=20mL时溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大
D.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
【答案】B
【解析】
图中曲线I为H2A,溶液中存在酸的分子,说明为弱酸;当V(NaOH)=20mL时,溶液主要为NaHA,电离为主,溶液显酸性,根据电荷守恒和物料守恒分析。
A. H2A为弱酸,电离方程可逆,在水中的电离方程式是H2AH++HA-、HA-H++A2-,A错误;
B. 当V(NaOH)=20mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,故溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),B正确;
C. 等体积等浓度的NaOH溶液与H2A溶液混合后,溶液主要为NaHA,电离为主,溶液显酸性,溶液中的氢离子会抑制水的电离,所以溶液中水的电离程度比纯水小,C错误;
D. 当V(NaOH)=30mL时,溶液中电荷守恒为:c(H+)+c(Na+)=c(HA-)+2c(A2-)+c(OH-),物料守恒为:2c(Na+)=3c(HA-)+3c(A2-)+3c(H2A),所以溶液中存在以下关系:2c(H+)+3c(H2A)═c(A2-)+2 c(OH-),D错误。
答案为B。

【题目】(1)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
①则反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
②根据表中数据,可推知该反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
(2)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
(3)在容积为VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡时CO的转化率与温度、压强的关系如图所示。
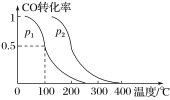
①p1__(填“大于”“小于”或“等于”)p2。
②在其他条件不变的情况下,再增加amolCO与2amolH2,达到新平衡时,CO的转化率__(填“增大”“减小”或“不变”,下同),平衡常数__。