题目内容
【题目】铁、铜及其化合物在工农业生产中应用广泛。
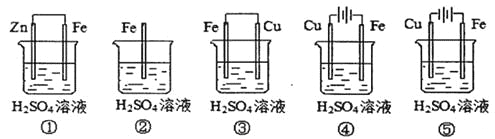
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为_______。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是____________(用序号填写)。
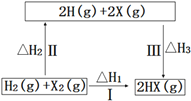
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)![]() H=-1118 kJ·mol-1
H=-1118 kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)![]() H=-1675.7 kJ·mol-1
H=-1675.7 kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为______________。
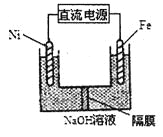
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式______。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是______________。
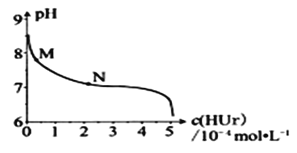
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是____________。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为____。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]=______。
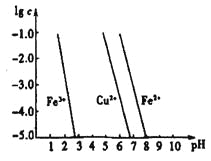
已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度![]() 10-5mol·L-1时,可认为沉淀完全)。
10-5mol·L-1时,可认为沉淀完全)。
【答案】2Fe + O2+ 2H2O = 2Fe(OH)2 ⑤③②①④ 8Al(s)+3Fe3O4(s)=4Al2O3(s)+9Fe(s) △H= 3349.8 kJ·mol-1 Fe + 8OH--6e-= FeO42-+ 4H2O Na2FeO4具有强氧化性,能起到杀菌、消毒作用;高价的铁被还原成的Fe3+水解生成Fe(OH)3胶体,能吸附水中杂质。 2Fe3+ + Cu = 2Fe2++Cu2+ Cu2+、Fe2+ 1.0×10-17(mol·L-1)3
【解析】
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为: 2Fe + O2+ 2H2O = 2Fe(OH)2;①Zn为负极,Fe为正极,Fe受到保护;②Fe与硫酸发生置换反应,被氧化变为Fe2+,比①腐蚀的快;③构成Fe-Cu原电池,Fe作负极,首先被腐蚀,腐蚀速率③>②;④形成电解池,Fe为阴极,被保护,只要存在外加电源,Fe就不会被腐蚀,所以腐蚀速率④<①;⑤构成电解池。由于Fe为阳极,被氧化,发生氧化反应,腐蚀速率比③快。所以铁腐蚀的速率由快到慢的顺序是⑤③②①④;
(2)②×4-①×3,整理可得:8Al(s)+3Fe3O4(s)=4Al2O3(s)+9Fe(s) △H= 3349.8 kJ·mol-1;(3)Na2FeO4具有强氧化性,其电解制法如图所示,则在阳极,Fe失去电子,被氧化,与溶液中的OH-结合反应,阳极的电极反应式是Fe + 8OH--6e-= FeO42-+ 4H2O;Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是Na2FeO4中的Fe化合价为+6价,具有强氧化性,能起到杀菌、消毒作用;高价的铁被还原成的Fe3+发生水解反应生成Fe(OH)3胶体,表面积大,吸附能力强,能吸附水中杂质,使之形成沉淀,从水中分离出去,从而使水得到净化。(4)工业上常用FeCl3溶液腐蚀印刷线路板,Fe3+将Cu单质氧化为Cu2+,Fe3+被还原变为Fe2+,根据电子守恒、电荷守恒及原子守恒,可得发生反应的离子方程式是2Fe3+ + Cu = 2Fe2++Cu2+;根据图像可知,在溶液的pH接近3而小于3时,Fe3+已经沉淀完全。所以在溶液的pH=5.6时,溶液中存在的金属阳离子为Cu2+、Fe2+;Fe(OH)2的溶度积Ksp[Fe(OH)2]=c(Fe2+)c2(OH-)=10-5×(10-14÷10-8)21.0×10-17(mol·L-1)3。

 全能练考卷系列答案
全能练考卷系列答案【题目】(1)已知:反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
①则反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
CO(g)+H2O(g)的平衡常数K可表示为K=__(用K1与K2来表示)
②根据表中数据,可推知该反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g)是__(填“吸热”或“放热”)反应。
(2)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为20%,则此时该反应__(填“达到平衡”或“向右移动”或“向左移动”),理由是__(通过计算说明理由)。
(3)在容积为VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡时CO的转化率与温度、压强的关系如图所示。
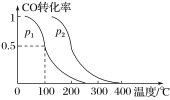
①p1__(填“大于”“小于”或“等于”)p2。
②在其他条件不变的情况下,再增加amolCO与2amolH2,达到新平衡时,CO的转化率__(填“增大”“减小”或“不变”,下同),平衡常数__。