题目内容
【题目】钛、铁、砷、硒、锌等元素的单质及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为_______,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有________种。
(2)铁的第三电离能![]() 、第四电离能
、第四电离能![]() 分别为
分别为![]() 和
和![]() ,
,![]() 远大于
远大于![]() 的原因是______________________。
的原因是______________________。
(3)![]() 离子可用于
离子可用于![]() 的检验,其对应的酸有两种,分别为硫氰酸
的检验,其对应的酸有两种,分别为硫氰酸![]() 和异硫氰酸
和异硫氰酸![]() 。
。
①写出与![]() 互为等电子体的一种微粒_________
互为等电子体的一种微粒_________![]() 分子或离子
分子或离子![]() ;
;
②异硫氰酸的沸点比硫氰酸沸点高的原因是_______________。
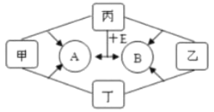
(4)成语“信口雌黄”中的雌黄分子式为![]() ,分子结构如图1所示,As原子的杂化方式为_______________。
,分子结构如图1所示,As原子的杂化方式为_______________。
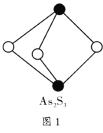
(5)离子化合物![]() 的晶胞结构如图2所示。一个晶胞含有的
的晶胞结构如图2所示。一个晶胞含有的![]() 键有__________个。
键有__________个。
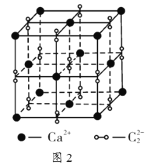
(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为____________![]() 填元素符号
填元素符号![]() ;该晶胞中硒原子所处空隙类型为____________
;该晶胞中硒原子所处空隙类型为____________![]() 填“立方体”、“正四面体”或“正八面体”
填“立方体”、“正四面体”或“正八面体”![]() ,该种空隙的填充率为____________;若该晶胞密度为
,该种空隙的填充率为____________;若该晶胞密度为![]() ,硒化锌的摩尔质量为
,硒化锌的摩尔质量为![]() 。用
。用![]() 代表阿伏加德罗常数的数值,则晶胞参数a为____________nm。
代表阿伏加德罗常数的数值,则晶胞参数a为____________nm。
【答案】球形 2 ![]() 的3d能级半充满,结构稳定
的3d能级半充满,结构稳定 ![]() 或
或![]() 、
、![]() 、
、![]() 异硫氰酸分子间存在氢键
异硫氰酸分子间存在氢键 ![]() 杂化
杂化 ![]()
![]() 正四面体
正四面体 ![]()
 。
。
【解析】
(1)根据构造原理写出核外电子排布式,判断出最高能级的形状,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同,结合构造原理与洪特规则特例,符合条件元素原子的价电子排布为3d54s1、3d104s1;
(2)价电子排布为全满或半满时,处于稳定结构,此时电离能将增大;
(3)C原子与1个单位负电荷可以等效替换为N原子,N原子与1个单位负电荷可以替换为O原子,S原子可以用氧原子替换,与SCN-互为等电子体的一种微粒为:N2O、CO2、CS2、OCN-(任意一种);从氢键的角度分析沸点的高低。
(4)由结构图可知,黑色球为As、白色球为S,分子中As原子形成3个σ键、还含有1对孤电子对,杂化轨道数目为3+1=4,故As杂化方式为sp3杂化;
(5)计算出晶胞中C22-数目,每个C22-中含2个π键;
(6)根据图示,Zn原子处于晶胞的顶点与面心,晶胞中Zn原子形成正四面体结构有8个,其中4个正四面体中心填充Se原子,正四面体空隙的填充率为50%;V=![]() =
=![]() =
=![]() ,N可以从晶胞构型中计算出N=4,NA、M、ρ均为已知,代入公式可以得到体积,晶胞参数等于体积的三次开方。
,N可以从晶胞构型中计算出N=4,NA、M、ρ均为已知,代入公式可以得到体积,晶胞参数等于体积的三次开方。
(1)基态Ti原子的核外电子排布式为[Ar]3d24s2,最高能层电子为4s能级,电子云轮廓图形为球形;与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同,结合构造原理与洪特规则特例,符合条件元素原子的价电子排布为3d54s1、3d104s1,故有2种,
故答案为:球形;2;
(2)由Fe2+变为Fe3+体现Fe的第三电离能,即价电子由3d6变为3d5;当从3d5状态再失去一个电子时,体现第四电离能,因3d5为半充满状态,较为稳定,故第四电离能大于第三电离能,
故答案为:Fe3+的3d能级半充满,结构稳定;
(3)①C原子与1个单位负电荷可以等效替换为N原子,N原子与1个单位负电荷可以替换为O原子,S原子可以用氧原子替换,与SCN-互为等电子体的一种微粒为:N2O、CO2、CS2、OCN-(任意一种),
故答案为:![]() 或
或![]() 、
、![]() 、
、![]() ;
;
②异硫氰酸分子间含有氢键,故异硫氰酸的沸点比硫氰酸沸点高;
故答案为:异硫氰酸分子间存在氢键 ;
(4)由结构图可知,黑色球为As、白色球为S,分子中As原子形成3个σ键、还含有1对孤电子对,杂化轨道数目为3+1=4,故As杂化方式为sp3杂化,
故答案为:sp3杂化;
(5)晶胞中C22-数目为:12×![]() +1=4,每个C22-中含2个π键,一个晶胞含有平均有π键数目为:2×4=8,
+1=4,每个C22-中含2个π键,一个晶胞含有平均有π键数目为:2×4=8,
故答案为:8;
(6)晶胞中Se、Zn原子数目之比为1:1,Zn原子处于晶胞的顶点与面心,Se原子与周围的4个Zn原子形成正四面体构型,Se处于正四面体的中心,X,Y都代表Zn;晶胞中Zn原子形成正四面体结构有8个,其中4个正四面体中心填充Se原子,正四面体空隙的填充率为50%;晶胞中Zn原子数目为:8×![]() +6×
+6×![]() =4、Se原子数目为4,晶胞中各微粒总质量为:
=4、Se原子数目为4,晶胞中各微粒总质量为:![]() g,晶胞体积为:
g,晶胞体积为: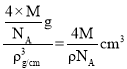 ,晶胞参数a=
,晶胞参数a=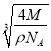 cm=
cm=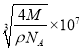 nm,
nm,
故答案为:![]() ;正四面体;
;正四面体;![]() ;
;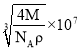 。
。