题目内容
1.反应:①N2O5(g)?N2O3(g)+O2(g)
②N2O3(g)?N2O(g)+O2(g)
在0.5L密闭容器中,将2.5mol N2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol•L-1,N2O3的平衡浓度为1.6mol•L-1,
则下列各项判断正确的是( )
| A. | N2O5的平衡浓度为3.0mol•L-1 | B. | N2O5的转化率为80% | ||
| C. | N2O的平衡浓度为4.4mol•L-1 | D. | N2O的平衡浓度为1.4mol•L-1 |
分析 根据N原子守恒:c平衡(N2O5)+c平衡(N2O3)+c平衡(N2O)=c起始(N2O5),根据O原子守恒:5c平衡(N2O5)+3c平衡(N2O3)+c平衡(N2O)+2c平衡(O2)=5c起始(N2O5),联立方程计算平衡时N2O5、N2O的平衡浓度,N2O5的转化率=$\frac{{N}_{2}{O}_{5}浓度变化量}{{N}_{2}{O}_{5}起始浓度}$×100%.
解答 解:N2O5的起始浓度为$\frac{2.5mol}{0.5L}$=5mol/L,
根据N原子守恒:c平衡(N2O5)+c平衡(N2O3)+c平衡(N2O)=c起始(N2O5),即:
c平衡(N2O5)+1.6mol/L+c平衡(N2O)=5mol/L,
根据O原子守恒:5c平衡(N2O5)+3c平衡(N2O3)+c平衡(N2O)+2c平衡(O2)=5c起始(N2O5),即:
5c平衡(N2O5)+3×1.6mol/L+c平衡(N2O)+2×4.4mol/L=5×5mol/L,
联立方程解得:c平衡(N2O5)=2mol/L,c平衡(N2O)=1.4mol/L,
N2O5的转化率为$\frac{5mol/L-2mol/L}{5mol/L}$×100%=60%,
由上述分析可知,ABC错误,D正确,
故选:D.
点评 本题考查化学平衡的有关计算,题目利用原子守恒进行计算解答,侧重考查学生分析计算能力,难度中等.

练习册系列答案
相关题目
19.配制250mL2.00mol/L的NaCl溶液,需要用到下列哪些仪器( )
| A. | 试管 | B. | 烧杯 | C. | 量筒 | D. | 锥形瓶 | ||||
| E. | 容量瓶 | F. | 玻璃棒 |
12.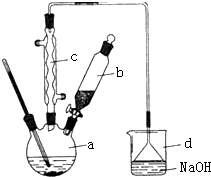 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
(1)写出a中生成溴苯的化学方程式 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr;
+HBr;
(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体,继续滴加至液溴滴完.装置d装置的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯;要进一步提纯,下列操作中必须的是D(填入正确选项前的字母).
A.重结晶 B.过滤 C.萃取 D.蒸馏.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr;
+HBr;(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体,继续滴加至液溴滴完.装置d装置的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯;要进一步提纯,下列操作中必须的是D(填入正确选项前的字母).
A.重结晶 B.过滤 C.萃取 D.蒸馏.
 (Ⅰ)一研究性学习小组对某工业城市的空气污染进行了下列研究.
(Ⅰ)一研究性学习小组对某工业城市的空气污染进行了下列研究.