题目内容
6.(1)1mol分子式为CnHmO2的有机物在O2中完全氧化后,所产生的CO2和H2O(g)的体积相等,并消耗78.4L(标准状况)O2.该有机物的碳原子数n是3(2)6.0g某有机物A完全燃烧后,生成标况下的CO26.72L和7.2g H2O,测得该化合物的蒸气对氢气的相对密度是30,该化合物的分子式为C3H8O.
分析 (1)分子式为CnHmO2的有机物在氧气中完全燃烧后,产生等物质的量的CO2和H2O,说明n=2m,且1mol完全燃烧消耗$\frac{78.4L}{22.4L/mol}$=3.5mol氧气,则m+$\frac{n}{4}$-1=3.5,据此计算出n;
(2)在相同条件下气体的相对分子质量之比等于密度之比,以此计算该化合物的相对分子质量,根据生成CO2气体的体积、水的质量可计算出1molA分子中含有的C、H原子数,结合A的相对分子质量可确定A的分子式.
解答 解:(1)解:标准状况下78.4L氧气的物质的量为:n(O2)=$\frac{78.4L}{22.4L/mol}$=3.5mol,
该有机物燃烧的方程式为CmHnO2+(m+$\frac{n}{4}$-1)O2$\stackrel{点燃}{→}$mCO2+$\frac{n}{2}$H2O,
该有机物燃烧产生的CO2和H2O(g)的体积相等,则:n=2m,
根据1mol该有机物完全燃烧消耗氧气的物质的量可知:m+$\frac{n}{4}$-1=3.5,
解得:n=6、m=3,
所以该有机物的碳原子数n=3,
故答案为:3;
(2)A的蒸气与氢气的相对密度为30,则Mr(A)=30×2=60,6.0gA的物质的量是:$\frac{6.0g}{60g/mol}$=0.1mol,
完全燃烧后生成CO2和 H2O的物质的量分别为n(CO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol、n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,
则A分子中含有的C、H原子数为:N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.4mol×2}{0.1mol}$=8,
A分子中含有的C、H的总原子量为:12×3+1×8=44<60,
所以A分子中含有O元素,且含有氧原子的数目为:N(O)=$\frac{60-44}{16}$=1,
故A的分子式是C3H8O,
故答案为:C3H8O.
点评 本题考查有机物分子式的确定,题目难度中等,明确相对密度的含义为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用方法,试题培养了学生的化学计算能力.

| A. | 标况下,混合气体的平均分子量可表示为22.4•混合气体的平均密度 | |
| B. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| C. | 1.0L1mol/L的NaOH溶液中所含氧原子数为1NA | |
| D. | 常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
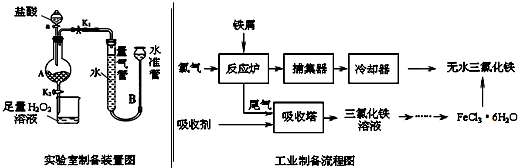
已知:(1)无水FeCl3的熔点为555K、沸点为588K.
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.请回答:
(1)实验室制备装置图中,向A中加入盐酸的仪器是分液漏斗,烧杯中加入足量的H2O2溶液的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)为了测定废铁屑中铁的质量分数,可使铁完全与盐酸反应,利用右边装置测定生成的氢气的体积.则操作Ⅱ中“…”的内容是装置A中不产生气泡或量气管和水准管液面不变.
(3)工业制备中反应炉中发生反应的化学方程式为2Fe+3Cl2=2FeCl3.吸收塔中用FeCL2溶液做吸收剂吸收尾气,反应的离子方程式2Fe2++Cl2=2Fe3+.
(4)工业制备过程中,从三氯化铁溶液获得FeCL3.6H2O的操作是加入稀盐酸后蒸发浓缩、冷却结晶、过滤.
(5)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1 Na2S2O3溶液滴定,消耗V mL.[已知:I2+2S2O32-═2I-+S4O62-,M(FeCL3)=162.5g/mol)]
①配制溶液时需要的仪器有天平(带砝码)、药匙、烧杯、玻璃棒、胶头滴管、100mL的容量瓶.
②样品中氯化铁的质量分数$\frac{162.5cV}{m}$%.
①N2O5(g)?N2O3(g)+O2(g)
②N2O3(g)?N2O(g)+O2(g)
在0.5L密闭容器中,将2.5mol N2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol•L-1,N2O3的平衡浓度为1.6mol•L-1,
则下列各项判断正确的是( )
| A. | N2O5的平衡浓度为3.0mol•L-1 | B. | N2O5的转化率为80% | ||
| C. | N2O的平衡浓度为4.4mol•L-1 | D. | N2O的平衡浓度为1.4mol•L-1 |
| A. | NH3•H2O | B. | HCl | C. | H2SO4 | D. | CO2 |
| A. | 950mL 111.2g | B. | 500mL 117g | ||
| C. | 1 000mL 117g | D. | 任意规格 111.2g |
