题目内容
10.为完成如表实验所选择的装置正确的是( )| 选项 | A | B | C | D |
| 实验 | 除去氯化钠晶体中混有的氯化铵晶体 | 分离CCl4中的I2 | 分离酒精和水 | 除去CO气体中的CO2气体 |
| 装置 | 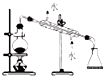 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.除去氯化钠晶体中混有的氯化铵晶体,可用加热的方法;
B.分离CCl4中的I2应用蒸馏的方法;
C.分离酒精和水应该用蒸馏操作;
D.除去CO气体中的CO2气体,可通过氢氧化钠溶液洗气.
解答 解:A.除去氯化钠晶体中混有的氯化铵晶体,可用加热的方法,氯化铵在加热条件下易分解,不能用蒸馏的方法,故A错误;
B.分离CCl4中的I2应用蒸馏的方法,不能用过滤的方法,二者互溶但沸点不同,可用蒸馏操作分离,故B错误;
C.酒精与水以任意比互溶,不能通过分液操作分离,可用蒸馏操作完成,故C错误;
D.CO不与氢氧化钠溶液反应,二氧化碳与氢氧化钠溶液反应,所以除去CO气体中的CO2气体,可用氢氧化钠溶液洗气,故D正确;
故选D.
点评 本题考查了化学实验装置的应用,题目难度不大,明确常见物质的性质及实验装置的使用方法为解答关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
1.反应:
①N2O5(g)?N2O3(g)+O2(g)
②N2O3(g)?N2O(g)+O2(g)
在0.5L密闭容器中,将2.5mol N2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol•L-1,N2O3的平衡浓度为1.6mol•L-1,
则下列各项判断正确的是( )
①N2O5(g)?N2O3(g)+O2(g)
②N2O3(g)?N2O(g)+O2(g)
在0.5L密闭容器中,将2.5mol N2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol•L-1,N2O3的平衡浓度为1.6mol•L-1,
则下列各项判断正确的是( )
| A. | N2O5的平衡浓度为3.0mol•L-1 | B. | N2O5的转化率为80% | ||
| C. | N2O的平衡浓度为4.4mol•L-1 | D. | N2O的平衡浓度为1.4mol•L-1 |
18.使溶液中的Al3+完全转化成Al(OH)3,应选择的最好试剂是( )
| A. | NH3•H2O | B. | HCl | C. | H2SO4 | D. | CO2 |
2.下列气体的排放不会造成酸雨的是( )
| A. | SO2 | B. | NO | C. | NO2 | D. | CO2 |
19.近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O═KIO3+3H2↑.下列有关说法正确的是( )
| A. | 电解时,石墨作阴极,不锈钢作阳极 | |
| B. | 电解时,阳极反应是:I--6e-+3H2O═IO3-+6H+ | |
| C. | 溶液调节至强酸性,对生产有利 | |
| D. | 电解时溶液中I-向阴极迁移 |
20.火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2,下列说法正确的是( )
| A. | 每转移l.2 mol电子,有0.2mol硫被氧化 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1molCu2S,有4mol硫被氧化 | |
| D. | SO2只是氧化产物 |