题目内容
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
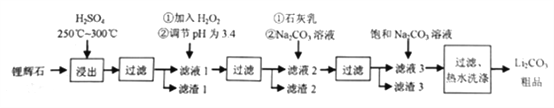
已知:①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量FeO、MgO等。
②Li2O·Al2O3·4SiO2+H2SO4![]() Li2SO4+Al2O3·4SiO2·H2O
Li2SO4+Al2O3·4SiO2·H2O
③某些物质的溶解度(S)如下表所示。
T℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
④Fe3+完全沉淀时pH为3.4
(1)为提高原料浸出速率,除升高温度外还可采取的措施是__________(任写一条)。
(2)在滤液1中加入H2O2的目的是__________(用离子方程式表示);调节pH最佳试剂是__________(填序号 )。
A.CuO B.CuCO3 C.MgO D.NH3·H2O
(3)从滤渣中分离出Al2O3的流程如下图所示,请写出生成沉淀的离子方程式__________。
![]()
(4)向滤液2中加入Na2CO3溶液的作用是__________。
(5)“过滤、热水洗涤”步骤中,“热水洗涤”的原因是__________;证明沉淀已洗净的操作是__________。
【答案】适当增大硫酸浓度、减小原料颗粒直径、搅拌等(合理答案均可给分) 2Fe2++H2O2+2H+ =2Fe3++2H2O C Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 使Ca2+完全转化为沉淀(或除去Ca2+) 碳酸锂在热水中溶解度较小,热水洗涤可减少产品损失 取最后一次洗涤液,加入盐酸酸化,滴加Ba2+溶液,若无沉淀产生,说明已洗净
【解析】
锂辉石(Li2OAl2O34SiO2,含少量少量FeO、MgO等)经过加入硫酸酸化得到可溶性的硫酸锂、硫酸铝、硫酸亚铁、硫酸镁和不溶的二氧化硅,经过过滤,得到滤渣1二氧化硅,滤液1加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH=3.4,Fe3+完全沉淀,过滤得到滤渣2为氢氧化铁,滤液2加入石灰乳和碳酸钠溶液,以增加Ca2+、OH-的浓度,使Mg(OH)2、CaCO3更利于析出,过滤得到滤液Mg(OH)2和CaCO3,以便形成滤渣3,滤液中加入饱和碳酸钠溶液沉淀锂离子生成Li2CO3的沉淀,过滤热水洗涤Li2CO3的溶解度随温度升高而减小,可减少Li2CO3的损失,得到最终产物碳酸锂。
(1)为提高原料浸出速率,除升高温度外还可采取的措施是:适当增大硫酸浓度、减小原料颗粒直径、搅拌等,故答案为:适当增大硫酸浓度、减小原料颗粒直径、搅拌等;
(2)在滤液1中加入H2O2的目的是氧化亚铁离子调节溶液pH沉淀铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,调节pH最佳试剂是不能引入新的杂质,AB会引入铜离子,D会引入铵根离子,所以调节pH最佳试剂是C氧化镁,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;C;
(3)从滤渣中分离出Al2O3的流程如下所示,其中生成沉淀的反应是铝盐和过量氨水生成,反应的离子方程式Al3++3NH3H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(4)向滤液2中加入Na2CO3溶液的作用是使Ca2+完全转化为沉淀(或除去Ca2+),故答案为:使Ca2+完全转化为沉淀(或除去Ca2+);
(5)图表数据可知碳酸锂溶解度随温度升高减小,“过滤、热水洗涤”步骤中,“热水洗涤”的原因是碳酸锂在热水中溶解度较小,热水洗涤可减少产品损失,证明沉淀已洗净的操作是:取最后一次洗涤液,加入盐酸酸化,滴加Ba2+溶液,若无沉淀产生,说明已洗净,故答案为:碳酸锂在热水中溶解度较小,热水洗涤可减少产品损失;取最后一次洗涤液,加入盐酸酸化,滴加Ba2+溶液,若无沉淀产生,说明已洗净。