题目内容
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是H+)和水分子通过。其工作原理的示意图如下,请回答下列问题:

(1)该装置的能量转化形式为________。
(2)Pt(a)电极是电池________(填“正”或“负”)极;
(3)电解液中的H+向_____(填“a”或“b”)极移动;
(4)如果该电池工作时消耗1 mol CH3OH,则电路中通过___ mol电子。
(5)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是________。
【答案】化学能转化为电能 负 b 6 对环境无污染
【解析】
该原电池中质子交换膜只允许质子和水分子通过,说明电解质溶液为酸性溶液,燃料电池中,通入燃料的电极为负极,负极上失电子发生氧化反应,电极反应为:CH3OH+H2O-6e-═CO2+6H+,通入氧气的电极为正极,氧气得到电子生成氢氧根离子,电极反应O2+4H++4e-═2H2O,据此解答。
(1)该装置的能量转化形式为原电池反应是化学能转化为电能;
(2)Pt(a)电极甲醇通入失电子发生氧化反应,是电池负极;
(3)燃料电池中,通入燃料的电极Pt(a)为负极,负极上失电子发生氧化反应,通入氧气的电极Pt(b)为正极,氧气得到电子生成氢氧根离子,电解液中的H+向正极移动,即向b电极移动;
(4)通入燃料的电极为负极,负极上失电子发生氧化反应,电极反应为:CH3OH+H2O-6e-═CO2+6H+,电子守恒,该电池工作时消耗1 mol CH3OH,则电路中通过6mol电子;
(5)燃料电池的能量转化率高,甲醇反应产物为CO2和H2O,对环境无污染。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
实验 序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=_________,T1=_______;通过实验___________可探究出温度变化对化学反应速率的影响。
(2)C组实验中液褪色时间t1______(填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = _________________。(用含有t1的式子表示)
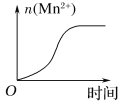
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:______________。
【题目】X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金属性最强的在周期表中的位置是________________________________;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是____________________。
(2)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_______(填化学
式),其电离方程式为_____________________________________。
(3)M与Z相比,非金属性较强的是_____________(填元素名称),请从原子结构的角度说明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
请配平,当有0.5 mol H2O2参加此反应,电子转移的个数为______________________。



