题目内容
【题目】在一固定容积的密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应进行到10秒时,SO2、O2、SO3的物质的量分别为0.2mol、0.1mol、0.2mol,则下列说法正确的是
2SO3(g),已知反应进行到10秒时,SO2、O2、SO3的物质的量分别为0.2mol、0.1mol、0.2mol,则下列说法正确的是
A .10秒时,用O2表示该反应的平均反应速率为0.01mol/(L·s)
B.当反应达到平衡时,SO3的物质的量可能为0.4mol
C.档SO2和O2的生成速率之比为2:1时,达到该反应限度
D.向容器内充入SO2,可以提高反应速率
【答案】D
【解析】
试题分析:依据化学平衡三段式列式计算;
2SO2(g)+O2(g) ![]() 2SO3(g),
2SO3(g),
起始量(mol) 0.4 0.2 0
变化量(mol) 0.2 0.1 0.2
10时的量(mol) 0.2 0.1 0.2
A.用O2表示该反应的平均反应速率=v(O2)=△c÷△t,容器的体积不知,不能计算变化的浓度,错误;B.假设生成三氧化硫0.4mol,依据化学方程式计算可知需要二氧化硫全部转化,但反应是可逆反应不能进行彻底,错误;C.当SO2和O2的生成速率之比为2:1时说明平衡逆向进行,但不能说明反应达到平衡,错误;D.加入二氧化硫增大反应物的浓度,增大反应速率,正确。

 阅读快车系列答案
阅读快车系列答案【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
实验 序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=_________,T1=_______;通过实验___________可探究出温度变化对化学反应速率的影响。
(2)C组实验中液褪色时间t1______(填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = _________________。(用含有t1的式子表示)
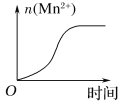
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:______________。
【题目】X、Y、Z、M、W、Q、R是7种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | W | Q | R |
原子半径/nm | 0.186 | 0.143 | 0.104 | 0.099 | 0.070 | 0.066 | 0.032 |
主要化合价 | +1 | +3 | +6,﹣2 | +7,﹣1 | +5,﹣3 | ﹣2 | +1 |
完成下列填空:
(1)上述元素中,金属性最强的在周期表中的位置是________________________________;X、Y、Q各自形成的简单离子中,离子半径由大到小的顺序是_______(填离子符号)。
W和R按原子个数比1﹕4构成的阳离子所含的化学键是____________________。
(2)表中所列4种第三周期元素的最高价氧化物的水化物碱性最弱的是_______(填化学
式),其电离方程式为_____________________________________。
(3)M与Z相比,非金属性较强的是_____________(填元素名称),请从原子结构的角度说明理由_________________________________________________________________。
(4)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应,反应方程式如下:
![]() KMnO4+
KMnO4+![]() H2O2+
H2O2+![]() H2SO4 →
H2SO4 → ![]() K2SO4+
K2SO4+![]() MnSO4+
MnSO4+![]() O2↑+
O2↑+![]() H2O
H2O
请配平,当有0.5 mol H2O2参加此反应,电子转移的个数为______________________。