题目内容
【题目】设NA表示阿伏加德罗常数的值。回答下列问题:
(1)0.3mol NH3分子中所含原子数与__________个H2O分子中所含原子数相等。
(2)含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是__________
(3)—定条件下,16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为__________
(4)某混合盐溶液中含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为: 0.2mol·L-1、0.25mol·L-1、0.4mol·L-1,则c(SO42-) =__________。
【答案】0.4NA或2.408×10230.6mol106g·mol-10.15mol·L-1
【解析】
(1)根据N=nNA结合分子构成计算;
(2)根据离子化合物的构成计算;
(3)根据质量守恒定律计算;
(4)根据溶液的电荷守恒计算。
(1)0.3mol NH3分子中所含原子数为0.3![]() 4NA=1.2 NA,因1molH2O分子含有3mol原子,则含有1.2 NA 个原子的H2O分子的物质的量应为0.4mol,即0.4 NA个H2O分子,
4NA=1.2 NA,因1molH2O分子含有3mol原子,则含有1.2 NA 个原子的H2O分子的物质的量应为0.4mol,即0.4 NA个H2O分子,
因此,本题正确答案是:0.4 NA或2.408×1023;
(2)Al2(SO4)3中N(Al3+):N(SO42-)=2:3,则含0.4mol Al3+的Al2(SO4)3中中所含的SO42-的物质的量是0.4mol![]() =0.6mol,
=0.6mol,
因此,本题正确答案是:0.6mol;
(3) 16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则m(A)+m(B)=m(C)+m(D),m(C)=16g+20g-31.76g=4.24g,
M(C)=![]() =106g
=106g![]() mol-1,
mol-1,
因此,本题正确答案是:106g·mol-1;
(4)溶液遵循电荷守恒:c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),
则0.2mol/L+2×0.25mol/L=0.4mol/L+2 c(SO42-),
c(SO42-)=0.15mol/L,
因此,本题正确答案是:0.15mol·L-1。

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
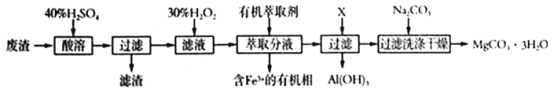
第三学期赢在暑假系列答案【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:

已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________________________________________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为__________________________________。
(3)滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。写出LiCoO2和盐酸反应的化学方程式__________________________________。
(4)滤渣的主要成分为____________________(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为___________mol·L-1
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________。