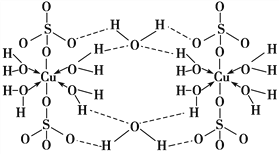
��Ŀ����
����Ŀ���ݱ������ҹ�������о�����ش�ͻ�ƣ�δ��ʮ���г�����ͻ��1000����Ԫ��ij����ط�ӦΪ2VCl2+BrCl2�� ![]() 2VCl3+Br�����缫��Ϊ���Բ��ϣ���Һ������з�Ӧ������Ե������Һ��ģ��װ����ͼ��ʾ������˵������ȷ����
2VCl3+Br�����缫��Ϊ���Բ��ϣ���Һ������з�Ӧ������Ե������Һ��ģ��װ����ͼ��ʾ������˵������ȷ����
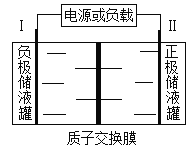
A. �ŵ�ʱ��I���ĵ缫��ӦʽΪVCl2��e��+Cl��= VCl3
B. �ŵ�ʱ��H+�ɽ���Ĥ�Ҳ������Ǩ��
C. ���ʱ��I�����Դ����������������ԭ��Ӧ
D. ���ʱ�������ĵ缫��ӦʽΪ2Cl��+Br����2e��= BrCl2��
���𰸡�B
��������A. IΪ�������ɷ���ط�Ӧʽ2VCl2+BrCl2�� ![]() 2VCl3+Br����֪���ŵ�ʱVCl2�ڸ���ʧ��������VCl3���缫��ӦʽΪVCl2��e��+Cl��= VCl3����A��ȷ��B. H+�������ӣ��ŵ�ʱH+��������������H+�ɽ���Ĥ������Ҳ�Ǩ������B����C. IΪ���������ʱ���ӵ�Դ�ĸ������ɵ��ص�������������ԭ��Ӧ����C��ȷ��D. IIΪԭ��ص����������ʱΪ���ص��������缫��ӦʽΪ2Cl��+Br���D2e��= BrCl2������D��ȷ����ѡB��
2VCl3+Br����֪���ŵ�ʱVCl2�ڸ���ʧ��������VCl3���缫��ӦʽΪVCl2��e��+Cl��= VCl3����A��ȷ��B. H+�������ӣ��ŵ�ʱH+��������������H+�ɽ���Ĥ������Ҳ�Ǩ������B����C. IΪ���������ʱ���ӵ�Դ�ĸ������ɵ��ص�������������ԭ��Ӧ����C��ȷ��D. IIΪԭ��ص����������ʱΪ���ص��������缫��ӦʽΪ2Cl��+Br���D2e��= BrCl2������D��ȷ����ѡB��

 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�����Ŀ��25 �棬������ĵ��볣�������ұ�������˵����ȷ����
�� | Ka1 | Ka2 |
H2SO3 | 1.3��10-2 | 6.3��10-6 |
H2CO3 | 4.2��10-7 | 5.6��10-11 |
A. H2CO3�ĵ��뷽��ʽΪH2CO3![]() 2H+��CO
2H+��CO![]()
B. ����ǿ��˳��ΪH2SO3��H2CO3��HSO��HCO
C. 0.2 mol/L Na2CO3��Һ������Ũ�ȴ�С˳��Ϊ��c(Na+)��c(CO![]() )��c(HCO)��c(OH��)��c(H+)
)��c(HCO)��c(OH��)��c(H+)
D. ����SO2����ͨ��NaHCO3��Һ�У���Ӧ�����ӷ���ʽΪSO2��HCO==HSO��CO2