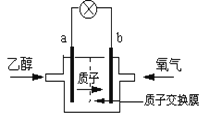
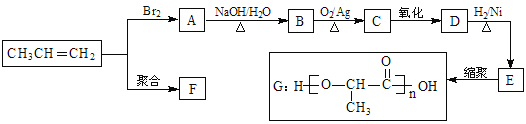
题目内容
【题目】已知元素aA、bB、cC、dD、eE的原子结构示意图分别为
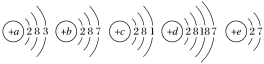
请回答下列问题:
(1)属于同周期的元素是________(填元素符号,下同),属于同主族的元素是________。
(2)金属性最强的元素是________,非金属性最强的元素是________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是________(填化学式)。
【答案】Na、Al、Cl F、Cl、Br Na F NaOH
【解析】
(1)根据电子层数与周期数相等,主族的族序数与最外层电子数相等分析。
(2)同周期从左到右金属性减弱,非金属性增强;同主族从上到下金属性增强,非金属性减弱。
(3)金属性越强,最高价氧化物对应的水化物碱性越强。
(1)弄清原子结构示意图与元素在周期表中的位置关系,即电子层数与周期数相等,所以A(Al)、B(Cl)、C(Na)同周期;主族的族序数与最外层电子数相等,所以B(Cl)、D(Br)、E(F)同主族;故答案为:Na、Al、Cl; F、Cl、Br。
(2)同周期从左到右金属性减弱,非金属性增强;同主族从上到下金属性增强,非金属性减弱。所以Na的金属性最强,F的非金属性最强;故答案为:Na;F。
(3)金属性越强,最高价氧化物对应的水化物碱性越强,上述元素中最高价氧化物对应的水化物碱性最强的是NaOH;故答案为:NaOH。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】下列选项中的原因或结论与现象不对应的是( )
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL0.010mol·L-1KSCN溶液,溶液呈红色,再滴加1ml1 mol·L-1KCl溶液,溶液颜色变浅 | 增大生成物浓度,平衡向逆反应方向移动 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 在密闭容器中有反应:A+xB(g) | 若A为气体、x>1 |
A.AB.BC.CD.D
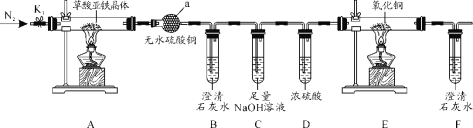
【题目】某校化学研究小组会试对校园附近空气质量进行测定请回答下列问题。
(1)甲组同学设计了如图所示的实验装置,对空气中SO2、悬浮颗粒物含量进行测定。下列装置连接的顺序为(填序号 )________________。

注:气体流速管是用来测量单位时间内通过气体的体积的装置
①用上述装置定量测定空气中的SO2和可吸入颗粒的含量,除测定气体流速(单位:cm3·min-1)外还需要测定____________、____________。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。请你协助甲组同学完成100mL 5×10-4mo1 L-1碘溶液的配制:
第一步:用电子天平准确称取1.27g碘单质加入烧杯中,______________。
第二步:将第一步所得溶液和洗涤液全部转入_____ mL的容量瓶中,加水定容,摇匀。
第三步:从第二步所得溶液中取出10.00mL溶液倒入100mL容量瓶中,加水稀释至刻度线,摇匀。
(2)乙组同学拟用如图简易装置测定空气中的SO2含量:

①检查该装置的气密性时,先在试管中装入适量的水(保证玻璃管的下端浸没在水中)。然后__________(填写操作方法)时。将会看到_____________(填写实验现象),则证明该装置的气密性良好。
②测定指定地点空气中的SO2含量准确移取1.00mL 5×10-4mo1L-1碘溶液,注入如图所示试管中。用适量的蒸馏水桸释后,再加2~3滴淀粉溶液,配制成溶液A。甲、乙两组同学分别使用如图所示相同的实验装置和溶液A,在同一地点、同时推拉注射器的活塞,反复抽气,直到溶液的蓝色全部褪尽为止停止抽气,记录抽气次数如下(假设每次抽气500mL)。
分组 | 甲组 | 乙组 |
抽气次数 | 110 | 145 |
我国环境空气质量标准对空气质量测定中SO2的最高浓度限值如下表:
最高浓度限值/mg·m-3 | ||
一级标准 | 二级标准 | 三级标准 |
0.15 | 0.50 | 0. 70 |
经老师和同学们分析,判断甲组测定结果更为准确,则该地点的空气中SO2 的含量为_______mgm-3(保留2 位有效数字),属于________(填汉字)级标准;请你分析乙组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题)______________。