题目内容
7.铝是地壳中含量最高的金属元素,其单质及合金在生活中的应用十分广泛.(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为:2Al2O 3$\frac{\underline{\;\;\;750℃-970℃\;\;\;}}{通电,Na_{3}AlF_{6}}$4Al+3O2.
其电极均由石墨材料做成,电解时不断消耗的电极是阳极(填“阴极”或“阳极”).
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命.以处理过的铝材为阳极,在H2SO4溶液
中电解,铝材表面形成氧化膜,阳极反应式为2Al+3H2O-6e-=Al2O3+6H+.
分析 (1)工业上用电解熔融氧化铝的方法制取氯气,氧化铝在通电条件下生成铝和氧气,阳极上生成氧气,氧气能够与碳反应;
(2)以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,电解过程中铝做阳极失去电子生成氧化铝,依据原子守恒和电子守恒写出电极反应;
解答 解:(1)工业上用电解熔融氧化铝的方法制取氯气,氧化铝在通电条件下生成铝和氧气,化学方程式:2Al2O 3$\frac{\underline{\;\;\;750℃-970℃\;\;\;}}{通电,Na_{3}AlF_{6}}$4Al+3O2,阳极上生成氧气,氧气能够与碳反应;
故答案为:2Al2O 3$\frac{\underline{\;\;\;750℃-970℃\;\;\;}}{通电,Na_{3}AlF_{6}}$4Al+3O2; 阳极;
(2)以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,电解过程中铝做阳极失去电子生成氧化铝,依据原子守恒和电子守恒写出电极反应为:2Al+3H2O-6e-=Al2O3+6H+,
故答案为:2Al+3H2O-6e-=Al2O3+6H+;
点评 本题以工业电解氧化铝制取铝为载体,考查了电解原理的应用,明确电解池工作原理是解题关键,注意电极反应式的书写方法,题目难度中等.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
19.近日某著名白酒生产企业又陷入“塑化剂”事件.据称“塑化剂”大量超标的白酒被人饮用后,可引起肝癌.常见的塑化剂DEHP分子结构如图:关于该塑化剂的说法错误的是( )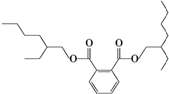

| A. | 塑化剂DEHP分子中含有碳、氢和氧三种元素 | |
| B. | 塑化剂DEHP分子中至少含有两种官能团 | |
| C. | 塑化剂DEHP分子易溶于酒精 | |
| D. | 塑化剂DEHP分子可发生取代反应 加成反应 |
18.下表为元素周期表中某一周期元素的原子结构示意图.
请回答下列问题:
(1)表中磷原子的核电荷数x=15.
(2)表中具有相对稳定结构的元素是氩元素.
(3)镁元素与氯元素形成的化合物的化学式为MgCl2.
(4)上述元素在周期表中处于同一周期的原因是原子核外电子层数相同.
(5)在化学反应中,每个铝原子失去3个电子形成铝离子.
(6)硫与氧气反应的化学方程式是:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;设N个氧气分子的质量为32g,则64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.
| 元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
| 元素符号 | Na | Mg | Al | Si | p | S | Cl | Ar |
| 原子结构 示意图 |  | 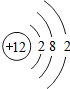 | 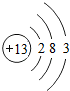 | 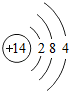 | 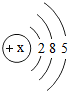 | 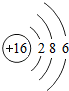 | 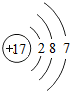 |  |
(1)表中磷原子的核电荷数x=15.
(2)表中具有相对稳定结构的元素是氩元素.
(3)镁元素与氯元素形成的化合物的化学式为MgCl2.
(4)上述元素在周期表中处于同一周期的原因是原子核外电子层数相同.
(5)在化学反应中,每个铝原子失去3个电子形成铝离子.
(6)硫与氧气反应的化学方程式是:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;设N个氧气分子的质量为32g,则64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.
15.下列氧化物中不属于酸性氧化物的是( )
| A. | CO2 | B. | NO2 | C. | SiO2 | D. | SO2 |
2.下列离子方程式错误的是( )
| A. | 铜溶于FeCl3溶液中:Cu+2Fe3+=2Fe2++Cu2+ | |
| B. | 石灰石和盐酸反应制CO2:CaCO3+2H+=CO2↑+Ca2++H2O | |
| C. | Ca(ClO)2 溶液中通入过量的SO2:C1O-+SO2+H2O=HClO+HSO${\;}_{3}^{-}$ | |
| D. | 稀Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO${\;}_{3}^{-}$=3Fe3++NO↑+2H2O |
12.把足量铝条放入盛有一定体积的稀盐酸的试管中,能使反应速率降低且不影响氢气产生量的因素是( )
| A. | 加入少量CuSO4溶液 | B. | 加入少量KNO3溶液 | ||
| C. | 加入少量的Na2CO3溶液 | D. | 加少量K2SO4溶液 |
19.下列各组离子,在溶液中可以大量共存的是( )
| A. | OH-、SO${\;}_{4}^{2-}$、H+、Ba2+ | B. | Cl-、NO${\;}_{3}^{-}$、Ba2+、Ag+ | ||
| C. | H+、Na+、Cl-、CO${\;}_{3}^{2-}$ | D. | Na+、SO${\;}_{4}^{2-}$、K+、Cl- |
16.下列说法正确的是( )
| A. | HCl、NaOH、BaSO4均属于电解质 | B. | CuSO4•5H2O属于混合物 | ||
| C. | 凡能电离出H+的化合物均属于酸 | D. | 盐类物质一定含有金属阳离子 |
17.同温同压下,甲容器中装有56gN2,乙容器中装有16gCH4,则甲、乙两容器的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |