题目内容
19.近日某著名白酒生产企业又陷入“塑化剂”事件.据称“塑化剂”大量超标的白酒被人饮用后,可引起肝癌.常见的塑化剂DEHP分子结构如图:关于该塑化剂的说法错误的是( )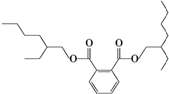
| A. | 塑化剂DEHP分子中含有碳、氢和氧三种元素 | |
| B. | 塑化剂DEHP分子中至少含有两种官能团 | |
| C. | 塑化剂DEHP分子易溶于酒精 | |
| D. | 塑化剂DEHP分子可发生取代反应 加成反应 |
分析 A.该塑化剂中含有C、H、O三种元素;
B.该塑化剂中含有酯基;
C.有机溶质易溶于有机溶剂;
D.该物质中含有苯环和酯基,具有苯和酯的性质.
解答 解:A.该塑化剂中含有C、H、O三种元素,故A正确;
B.该塑化剂中只含有酯基一种官能团,故B错误;
C.有机溶质易溶于有机溶剂,塑化剂和乙醇都是有机物,根据相似相溶原理知,塑化剂DEHP分子易溶于乙醇,故C正确;
D.该物质中含有苯环和酯基,具有苯和酯的性质,苯环能发生加成反应和取代反应,酯基能发生取代反应,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系、相似相溶原理等知识点是解本题关键,注意:酯基中碳氧双键不能发生加成反应,为易错点.

练习册系列答案
相关题目
9.对药品的作用和使用,下列说法正确的是( )
| A. | R表示非处方药,OTC表示处方药 | |
| B. | 使用青霉素时,直接静脉注射可以不用进行皮肤敏感试验 | |
| C. | 长期大量使用阿司匹林可以预防某些疾病,没有任何副作用 | |
| D. | 阿司匹林属于解热镇痛药 |
10.常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A. | 滴加甲基橙显黄色的溶液:Na+、NO3-、SO32-、Fe3+ | |
| B. | 加入Al粉能放出H2的溶液:Al3+、NO3-、HCO3-、Ba2+ | |
| C. | c(OH -)水=1×10-12的溶液:K+、NH4+、Cl -、SO42- | |
| D. | 能使pH试纸显深红色的溶液:Fe 2+、Cl -、Ba 2+、ClO - |
7.下列关于实验安全说法正确的是( )
| A. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 实验室可用燃着的酒精灯去点燃另一只酒精灯 | |
| D. | 将含硫酸的废液倒入水槽,用水冲入下水道 |
14. 称为“现代有机合成之父”的伍德沃德曾组织14个国家的110位化学家,协同攻关,探索维生素B12的结构,其结构如图对此结构的下列说法中,正确的是( )
称为“现代有机合成之父”的伍德沃德曾组织14个国家的110位化学家,协同攻关,探索维生素B12的结构,其结构如图对此结构的下列说法中,正确的是( )
 称为“现代有机合成之父”的伍德沃德曾组织14个国家的110位化学家,协同攻关,探索维生素B12的结构,其结构如图对此结构的下列说法中,正确的是( )
称为“现代有机合成之父”的伍德沃德曾组织14个国家的110位化学家,协同攻关,探索维生素B12的结构,其结构如图对此结构的下列说法中,正确的是( )| A. | 维生素B12属于有机物 | B. | 维生素B12属于无机物 | ||
| C. | 维生素B12属于烃 | D. | 维生素B12属于芳香族化合物 |
4.下列与含氯化合物有关的说法正确的是( )
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| D. | 电解NaCl溶液得到22.4L H2(标准状况),理论上需要转移NA个电子 |
11.在标准状况下进行甲、乙、丙三组实验.三组实验均各取30mL 1mol•L-1盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见下表:
(1)甲组中反应的离子方程式为Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑.
(2)乙组中盐酸不足(填“足量”或“不足量”).
(3)Mg、Al物质的量之比为1:1.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(2)乙组中盐酸不足(填“足量”或“不足量”).
(3)Mg、Al物质的量之比为1:1.
6. 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H=a kJ/mol.
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度为0).
回答下列问题:
(1)在上述条件下该反应能自发进行,则正反应必然是放热反应(填“放热”或“吸热”).
(2)前3s内的平均反应速率v(N2)=1.42×10-4 mol•L-1•s-;t1℃时该反应的平衡常数K=5000.
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是CD.
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图所示:
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为③②①.
(5)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H2=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H3=-393.5kJ/mol
则处理汽车尾气反应中的a=-746.5.
(6)用活性炭还原法也可以处理氮氧化物,有关反应为:
C(s)+2NO(g)?N2(g)+CO2(g)△H4.
向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如下表:
平衡后升高温度,再次达到平衡测得容器中NO、N2、CO2的浓度之比为5:3:3,则△H4<0(填“>”、“=”或“<”).
 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H=a kJ/mol.
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度为0).
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4 mol•L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(1)在上述条件下该反应能自发进行,则正反应必然是放热反应(填“放热”或“吸热”).
(2)前3s内的平均反应速率v(N2)=1.42×10-4 mol•L-1•s-;t1℃时该反应的平衡常数K=5000.
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是CD.
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图所示:
| 实验编号 | T/℃ | NO初始浓度/mol•L-1 | CO初始浓度/mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
(5)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H2=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H3=-393.5kJ/mol
则处理汽车尾气反应中的a=-746.5.
(6)用活性炭还原法也可以处理氮氧化物,有关反应为:
C(s)+2NO(g)?N2(g)+CO2(g)△H4.
向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如下表:
| NO | N2 | CO2 | |
| 起始浓度/mol•L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.04 | 0.03 | 0.03 |