题目内容
18.下表为元素周期表中某一周期元素的原子结构示意图.| 元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
| 元素符号 | Na | Mg | Al | Si | p | S | Cl | Ar |
| 原子结构 示意图 |  | 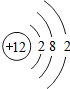 | 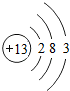 | 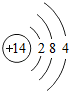 | 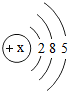 |  | 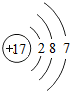 |  |
(1)表中磷原子的核电荷数x=15.
(2)表中具有相对稳定结构的元素是氩元素.
(3)镁元素与氯元素形成的化合物的化学式为MgCl2.
(4)上述元素在周期表中处于同一周期的原因是原子核外电子层数相同.
(5)在化学反应中,每个铝原子失去3个电子形成铝离子.
(6)硫与氧气反应的化学方程式是:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;设N个氧气分子的质量为32g,则64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.
分析 (1)根据原子中核电荷数=质子数=核外电子数,进行分析解答;
(2)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切进行解答;
(3)镁元素与氯元素形成的化合物时,镁失去2个电子,显+2价,氯得1个电子,显-1价,据此书写化学式;
(4)核外电子层数相同的原子的元素位于同一周期,据此答题;
(5)根据铝原子最外层电子数为3,容易失去3个电子进行解答;
(6)硫与氧气反应生成二氧化硫,根据反应方程式可计算出生成二氧化硫的物质的量,并计算出分子数.
解答 解:(1)根据磷原子的结构示意图可知,磷原子核外有15个电子,磷原子的核电荷数也为15,
故答案为:15;
(2)元素的化学性质跟它的原子的最外层电子数目关系非常密切,当最外层电子数为8,则具有相对稳定结构,所以具有相对稳定结构的元素是氩元素,
故答案为:氩元素;
(3)镁元素与氯元素形成的化合物时,镁失去2个电子,显+2价,氯得1个电子,显-1价,所以镁与氯化合的化学式为MgCl2,
故答案为:MgCl2;
(4)由元素周期表中某一周期元素的原子结构示意图可以看出,处于同一周期的原子,核外电子层数相同,
故答案为:原子核外电子层数相同;
(5)根据铝原子最外层电子数为3,容易失去3个电子,
故答案为:3;
(6)硫与氧气反应生成二氧化硫,反应的方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,根据反应方程式可知,每个氧分子反应生成1个二氧化硫分子,设N个氧气分子的质量为32g,64g氧气应为2N,与足量硫粉完全反应生成的二氧化硫分子数为2N,
故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;2.
点评 本题难度不大,考查学生对原子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是正确解题的关键.

| A. | 滴加甲基橙显黄色的溶液:Na+、NO3-、SO32-、Fe3+ | |
| B. | 加入Al粉能放出H2的溶液:Al3+、NO3-、HCO3-、Ba2+ | |
| C. | c(OH -)水=1×10-12的溶液:K+、NH4+、Cl -、SO42- | |
| D. | 能使pH试纸显深红色的溶液:Fe 2+、Cl -、Ba 2+、ClO - |
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(2)乙组中盐酸不足(填“足量”或“不足量”).
(3)Mg、Al物质的量之比为1:1.
 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H=a kJ/mol.
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度为0).
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4 mol•L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(1)在上述条件下该反应能自发进行,则正反应必然是放热反应(填“放热”或“吸热”).
(2)前3s内的平均反应速率v(N2)=1.42×10-4 mol•L-1•s-;t1℃时该反应的平衡常数K=5000.
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是CD.
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图所示:
| 实验编号 | T/℃ | NO初始浓度/mol•L-1 | CO初始浓度/mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
(5)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H2=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H3=-393.5kJ/mol
则处理汽车尾气反应中的a=-746.5.
(6)用活性炭还原法也可以处理氮氧化物,有关反应为:
C(s)+2NO(g)?N2(g)+CO2(g)△H4.
向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如下表:
| NO | N2 | CO2 | |
| 起始浓度/mol•L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.04 | 0.03 | 0.03 |
(1)固体成分的初步确定.
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用化学方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(2)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2,无明显变化.再加入H2O2溶液,红色很快褪去 |
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
| A. | 糖水 | B. | 石灰乳 | C. | 氢氧化铁胶体 | D. | 牛奶 |
| A. | 它不能使酸性高锰酸钾溶液褪色 | B. | 它能发生加成反应和酯化反应 | ||
| C. | 它不能与金属钠反应 | D. | 它不能发生氧化反应 |