题目内容
11.下列关于碱金属的叙述中,正确的是( )| A. | 金属钠着火时,可用水或泡沫灭火器灭火 | |
| B. | 碱金属单质都可保存在煤油中 | |
| C. | 钠离子核外电子数比钠原子核外电子数少 | |
| D. | 碱金属中密度最小,熔、沸点最高的是铯 |
分析 A.钠和水反应生成氢气,钠燃烧生成的过氧化钠和水、二氧化碳反应;
B.Li不能保存在煤油中;
C.钠原子失去一个电子生成钠离子;
D.碱金属族元素中,其单质的熔沸点随着原子序数增大而减小,其密度随着原子序数增大而呈增大趋势.
解答 解:A.钠和水反应生成氢气,钠燃烧生成的过氧化钠和水、二氧化碳反应生成氧气,从而促进钠的燃烧,所以金属钠着火时,不可用水或泡沫灭火器灭火,应该用沙土覆盖,故A错误;
B.Li密度小于煤油,所以Li不能保存在煤油中,故B错误;
C.钠原子失去一个电子生成钠离子,所以钠离子核外电子数比钠原子核外电子数少1个,故C正确;
D.碱金属族元素中,其单质的熔沸点随着原子序数增大而减小,其密度随着原子序数增大而呈增大趋势,所以从Li到Cs中,Cs密度最大、熔沸点最低,故D错误;
故选C.
点评 本题考查碱金属族元素性质递变规律,为高考高频点,熟悉元素周期表结构、同一主族元素性质递变规律即可解答,知道钠着火不能用水或泡沫灭火器灭火原理,题目难度不大.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
1.已知A、B、C、D、E是5种短周期元素,C、D、E是原子序数依次递增的同周期元素,A的最外层电子数是其电子层数的3倍,B是组成有机物的必要元素,元素D与B为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A. | 原子半径:D>E>B>A | |
| B. | C和E的单质可通过电解饱和的CE水溶液获得 | |
| C. | C与A形成的两种化合物中化学键类型和晶体类型完全相同 | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
6.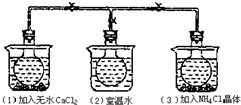 如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
 如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )| A. | CaCl2溶于水时放出热量 | B. | 烧瓶(1)中气体的压强增大 | ||
| C. | NH4Cl溶于水时放出热量 | D. | 烧瓶(3)中气体的压强减小 |
16.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,Y的性质稳定,而Z不能形成双原子分子.根据以上叙述,下列说法中正确的是( )
| A. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 | |
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| D. | W不能与同族元素形成离子化合物 |
3.下列化合物中,既能发生消去反应,又能发生水解反应的是( )
| A. | 氯仿 | B. | 1-氯甲烷 | C. | 乙醇 | D. | 氯乙烷 |
20.下列指定微粒的个数比为2:1的是( )
| A. | Be2+离子中的质子和电子 | B. | H原子中的中子和质子 | ||
| C. | NaHCO3晶体中的阳离子和阴离子 | D. | Na2O2固体中的阴离子和阳离子 |
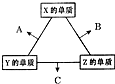 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O.
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O.