题目内容
12.某同学进行淀粉水解实验.其程序如下:在淀粉溶液中加入A的稀溶液后加热一段时间,取少量所得混合物,先加入B的稀溶液后再加入C的悬浊液,加热可得砖红色沉淀.(1)各步加入的试剂的化学式:AH2SO4,BNaOH,CCu(OH)2.
(2)加入A溶液而不加入B溶液是否可以否,其理由是葡萄糖和新制氢氧化铜的反应应该在碱性条件下进行
(3)如何验证淀粉是否水解完全加入碘水,看是否变蓝,若变蓝说明部分水解,若不变蓝说明水解完全.
分析 (1)根据淀粉的水解需要用稀硫酸作催化剂、葡萄糖和新制氢氧化铜的反应应该在碱性条件下进行判断各试剂名称及化学式;
(2)酸性条件下,氢氧化铜会与酸溶液反应,所以加入氢氧化铜悬浊液前必须使用氢氧化钠溶液中和;
(3)若是否完全溶解,加入碘水后溶液不会变蓝,据此进行解答.
解答 解:(1)淀粉需要在稀硫酸作催化剂条件下发生水解反应,所以A为H2SO4;得到的砖红色沉淀为氧化亚铜,说明试剂C为Cu(OH)2混悬液,葡萄糖和新制氢氧化铜的反应应该在碱性条件下进行,所以加入氢氧化铜悬浊液前需要用NaOH溶液中和,则B为NaOH,
故答案为:H2SO4;NaOH;Cu(OH)2;
(2)由于葡萄糖和新制氢氧化铜的反应应该在碱性条件下进行,所以加入氢氧化铜悬浊液前必须加入NaOH溶液中和,
故答案为:否;葡萄糖和新制氢氧化铜的反应应该在碱性条件下进行;
(3)淀粉遇到碘单质显示蓝色,所以向溶液中加入碘水,若变蓝说明淀粉没有完全水解,若不变蓝说明淀粉已经完全水解,
故答案为:加入碘水,看是否变蓝,若变蓝说明部分水解,若不变蓝说明水解完全.
点评 本题考查了淀粉水解的实验,题目难度中等,明确淀粉的水解原理及操作方法为解答关键,(2)为易错点,注意加入银氨溶液或氢氧化铁悬浊液前必须加入氢氧化钠溶液中和溶液中的氢离子,否则会影响测定结果.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列化合物中,既能发生消去反应,又能发生水解反应的是( )
| A. | 氯仿 | B. | 1-氯甲烷 | C. | 乙醇 | D. | 氯乙烷 |
20.下列指定微粒的个数比为2:1的是( )
| A. | Be2+离子中的质子和电子 | B. | H原子中的中子和质子 | ||
| C. | NaHCO3晶体中的阳离子和阴离子 | D. | Na2O2固体中的阴离子和阳离子 |
7.下列不是海水淡化主要方法的是( )
| A. | 电解法 | B. | 离子交换法 | C. | 电渗析法 | D. | 干馏法 |
17.等质量的下列有机物与足量的氧气完全燃烧,消耗氧气最多的是( )
| A. | 丙烯 | B. | 乙炔 | C. | 甲苯 | D. | 甲烷 |
1.在等温、等容条件下,有下列气体反应:2A(g)+2B(g)?C(g)+3D(g).现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol/L;Ⅱ.C和D的起始浓度分别为2mol/L和6mol/L.下列叙述正确的是( )
| A. | 达到平衡时,Ⅰ途径的反应速率V(A)等于Ⅱ途径的反应速率V(A) | |
| B. | 达到平衡时,第Ⅰ条途径混合气体的密度与第Ⅱ条途径混合气体的密度相同 | |
| C. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数相同 | |
| D. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数不同 |
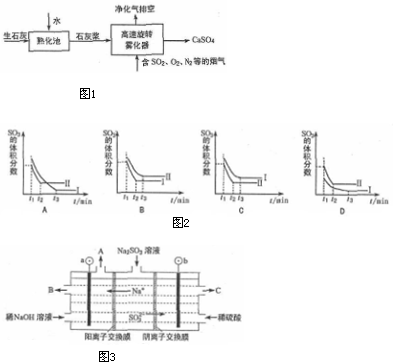
 .
.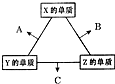 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O.
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O.