题目内容
【题目】氟是一种卤族元素。但它与其他卤素在单质和化合物的制备与性质上存在较明显的差异
(1)研究发现,SbF5能将MnF4从离子[MnF6]2-的盐中反应得到,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在423 K的温度下制备F2的化学方程式:____________________。
(2)现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
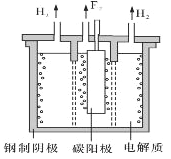
①已知KHF2是一种酸式盐,写出阴极上发生的电极反应式______________。
②电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是____________ 。
③HF的水溶液能用于蚀刻玻璃,其化学反应方程式为:_____________________。
④已知25℃时,氢氟酸(HF)的电离平衡常数Ka=3.6×10-4。某pH=2的氢氟酸溶液,由水电离出的c(H+)=_________mol/L;若将0.01 mol/L HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度大小关系为:__________________。
⑤又已知25℃时,溶度积常数Ksp(CaF2)=1.46×10-10。现向1L0.2 mol/L HF溶液中加入1L0.2 mol/L CaCl2溶液,____________(填“是”、“否”) 有沉淀产生,并通过列式计算说明__________________。
【答案】 2K2MnF6+4SbF5![]() 4KSbF6+2MnF3+F2↑ 2HF2-+2e-=H2↑+4F- 氟气和氢气能发生剧烈反应,引发爆炸 SiO2+4HF=SiF4↑+2H2O 10-12 c(Na+)>c(F-)>c(OH-)>c(H+) 是 c(H+)=c(F-)=6×l0-3mol ·L-1,c(Ca2+)=0.lmol·L-1,c(F-)2·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10, 该体系有CaF2 沉淀
4KSbF6+2MnF3+F2↑ 2HF2-+2e-=H2↑+4F- 氟气和氢气能发生剧烈反应,引发爆炸 SiO2+4HF=SiF4↑+2H2O 10-12 c(Na+)>c(F-)>c(OH-)>c(H+) 是 c(H+)=c(F-)=6×l0-3mol ·L-1,c(Ca2+)=0.lmol·L-1,c(F-)2·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10, 该体系有CaF2 沉淀
【解析】本题综合考查化学反应原理。(1)①以K2MnF6和SbF5为原料,在423 K的温度下, K2MnF6和SbF5反应先生成KSbF6和MnF4,MnF4受热易分解为MnF3和F2,故其化学方程式:2K2MnF6+4SbF5![]() 4KSbF6+2MnF3+F2↑;(2)①阴极上为氢离子(HF2-中的氢离子)放电生成氢气,其电极反应为:2HF2—+2e—=4F—+ H2↑;②F2与H2在暗处发生爆炸,因此电解制氟时,要用镍铜合金隔板将两种气体产物严格分开;③玻璃的主要成分为二氧化硅,故HF与二氧化硅反应的化学方程式为:SiO2+4HF=SiF4↑+2H2O;④pH=2的氢氟酸溶液,水的电离受到抑制,由水电离出的c(H+)水=c(OH—)水=c(OH—)==
4KSbF6+2MnF3+F2↑;(2)①阴极上为氢离子(HF2-中的氢离子)放电生成氢气,其电极反应为:2HF2—+2e—=4F—+ H2↑;②F2与H2在暗处发生爆炸,因此电解制氟时,要用镍铜合金隔板将两种气体产物严格分开;③玻璃的主要成分为二氧化硅,故HF与二氧化硅反应的化学方程式为:SiO2+4HF=SiF4↑+2H2O;④pH=2的氢氟酸溶液,水的电离受到抑制,由水电离出的c(H+)水=c(OH—)水=c(OH—)== 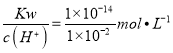 =10-12 mol/L;将0.01 mol/L HF溶液与pH=12的NaOH溶液等体积混合,恰好完全中和,所得溶液溶质为NaF,因F—水解,溶液呈碱性,结合电荷守恒可知溶液中离子浓度大小为:c(Na+)>c(F-)>c(OH-)>c(H+),⑤两溶液混合后,c(Ca2+)=0.1 mol/L,c(F—)=
=10-12 mol/L;将0.01 mol/L HF溶液与pH=12的NaOH溶液等体积混合,恰好完全中和,所得溶液溶质为NaF,因F—水解,溶液呈碱性,结合电荷守恒可知溶液中离子浓度大小为:c(Na+)>c(F-)>c(OH-)>c(H+),⑤两溶液混合后,c(Ca2+)=0.1 mol/L,c(F—)= ![]() ,则Qc(CaF2)= c2(F-)×c(Ca2+)=(6×10-3mol/L)2×0.1 mol/L=3.6×10-6>Ksp(CaF2),说明有沉淀产生。
,则Qc(CaF2)= c2(F-)×c(Ca2+)=(6×10-3mol/L)2×0.1 mol/L=3.6×10-6>Ksp(CaF2),说明有沉淀产生。

 备战中考寒假系列答案
备战中考寒假系列答案