题目内容
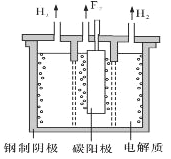
【题目】下列装置能构成原电池的是__________________________。
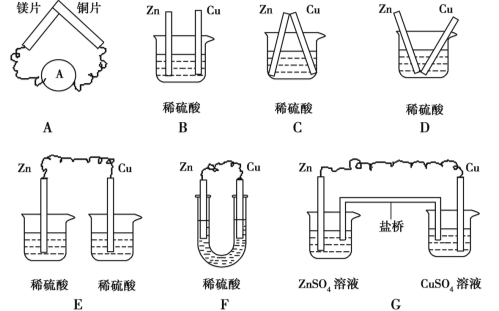
【答案】CFDG
【解析】紧扣原电池的构成条件逐项判断。A项中缺少电解质溶液,不能构成原电池;B项中Zn、Cu未用导线连接,不能形成闭合回路,不能构成原电池;C项中Zn、Cu接触,通过电解质溶液发生原电池反应,属于原电池装置;D项中Zn、Cu接触,能构成原电池;E项中稀硫酸分装在两个容器中,不能形成闭合电路,不能构成原电池;F项中Zn、Cu用导线连接,形成闭合回路,能发生原电池反应,属于原电池装置;G项中两容器用盐桥相连形成闭合回路,能发生原电池反应,属于原电池装置。
【备注】(1)构成原电池的四个基本条件是相互联系的,不能孤立、片面地看待某一条件。在四个基本条件中,氧化还原反应是核心。
(2)判断某装置是否为原电池,要以构成原电池的基本条件为标准进行判断,不能仅凭装置的外形下结论。
(3)构成原电池的基本条件是进行原电池设计的基本依据。

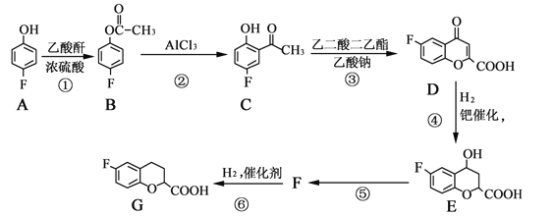
【题目】CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:
![]()
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种。生成晶种的化学方程式为_____________________。
(2)步骤②将晶种移到放有FeSO4溶液和铁皮的生长槽中,升温到60℃,吹入空气,待晶种长大到一定尺寸后,过滤、水洗、干燥,得FeOOH粉末。生长槽中放入铁皮的目的是_______,吹入空气的作用为_____________________。
(3)步骤③将FeOOH在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的___________(填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(4)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为______________________________________________。
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4·7H2O晶体。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Co2+ | 6.9 | 9.4 |
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液):
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝。
② _____________________________________________________。
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤。
④_______________________________________________________。
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4·7H2O晶体。
【题目】下列叙述正确的是( )
A. 化学反应中需要加热的反应一定是吸热反应
B. 化学反应中不需要加热的反应一定是放热反应
C. 熵增加且吸热的反应一定是自发反应
D. 化学反应总是伴随着物质变化和能量变化
【题目】下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | H2CO3 | AgCl | Ag2CrO4 |
Ka或Ksp | Ka=1.8×10-5 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ksp=1.8×10-10 | Ksp=2.0×10-12 |
A. 常温下,相同浓度①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3溶液中,c(NH4+)由大到小的顺序是:①>②>③
B. AgCl 易溶于氨水难溶于水,所以AgCl 在氨水中的Ksp 大于水中的 Ksp
C. 向饱和氯水中滴加NaOH 溶液至溶液刚好为中性时,c(Na+)=2c(ClO-)+c(HClO)
D. 向浓度均为1×10-3molL-1的KCl 和K2CrO4混合液中滴加1×10-3molL-1 的AgNO3溶液,CrO42-先形成沉淀