题目内容
【题目】(1)有下列几组物质,请将序号填入下列空格内:
A、CH2=CH-COOH和油酸(C17H33COOH) B、12C60和石墨 C、 ![]() 和
和![]() D、35Cl和37Cl E、乙醇和乙二醇
D、35Cl和37Cl E、乙醇和乙二醇
①互为同位素的是______________;②互为同系物的是_________________;
③互为同素异形体的是__________;④互为同分异构体的是_____________;
⑤既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是______
(2)请写出下列反应的化学方程式:
①丙氨酸缩聚形成多肽:____________________________________________________________
②淀粉水解:______________________________________________________________________
③丙醛与新制的氢氧化铜悬浊液反应:________________________________________________
(3)已知涤纶树脂的结构简式如下图所示,请写出合成涤纶树脂所需要单体的结构简式:
 ________________和_________________
________________和_________________
【答案】 D A B C E 略 略 略 HOOC-C6H4-COOH HOCH2CH2OH
【解析】(1).①.35Cl和37Cl质子数都为17,中子数不同,是氯元素的不同原子,互为同位素,故答案为:D;
②.CH2=CH-COOH和油酸(C17H33COOH)结构相似、通式相同,分子式相差15个CH2原子团,互为同系物,故答案为:A;
③.12C60和石墨是由碳元素组成的不同单质,互为同素异形体,故答案为:B;
④. ![]() 和
和![]() 分子式相同,结构不同,互为同分异构体,故答案为:C;
分子式相同,结构不同,互为同分异构体,故答案为:C;
⑤乙醇和乙二醇的官能团相同都是羟基,但二者中羟基个数分别是1个和2个,所以二者不是同系物、也不是同分异构体,更不是同素异形体,二者都是醇类物质,所以为同一类物质,故答案为:E。
(2).①.丙氨酸含有羧基和氨基,可发生缩聚反应,反应的方程式为n NH2CH(CH3)COOH ![]() NH2-[-CH(CH3)CO-]n-OH+(n-1)H2O,故答案为:n NH2CH(CH3)COOH
NH2-[-CH(CH3)CO-]n-OH+(n-1)H2O,故答案为:n NH2CH(CH3)COOH ![]() NH2-[-CH(CH3)CO-]n-OH+(n-1)H2O;
NH2-[-CH(CH3)CO-]n-OH+(n-1)H2O;
②. 淀粉在酸性环境下水解的最终产物是葡萄糖,化学方程式为:(C6H10O5)n +n H2O
![]() n C6H12O6,故答案为:(C6H10O5)n +n H2O
n C6H12O6,故答案为:(C6H10O5)n +n H2O![]() n C6H12O6;
n C6H12O6;
③..丙醛与新制的氢氧化铜悬浊液在加热条件下发生反应生成丙酸和氧化亚铜,方程式为2C2H5OH+O2 ![]() 2CH3CHO+2H2O,故答案是:2C2H5OH+O2
2CH3CHO+2H2O,故答案是:2C2H5OH+O2 ![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3). 根据涤纶树脂的结构: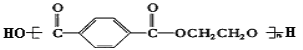 可知,从酯基中碳氧单键处断键时即可以得到合成涤纶树脂的单体,分别为:HOOC-C6H4-COOH和HOCH2CH2OH,故答案是:HOOC-C6H4-COOH;HOCH2CH2OH。
可知,从酯基中碳氧单键处断键时即可以得到合成涤纶树脂的单体,分别为:HOOC-C6H4-COOH和HOCH2CH2OH,故答案是:HOOC-C6H4-COOH;HOCH2CH2OH。

【题目】(1)把一端弯成螺旋状的铜丝放在酒精灯外焰部分加热,可看到铜丝表面变_______色,生成的物质是__________,立即将它插入盛乙醇的试管中,发现铜丝表面变______色,试管中有_________气味的物质生成,其化学方程式是_____________________________________。
(2)实验室制备乙酸乙酯的主要步骤如下:①在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液 ②用小火加热试管内的混合物 ③把产生的蒸气经导管通到盛有饱和Na2CO3溶液的大试管中 ④分离出纯净的乙酸乙酯。 填写下列空白:
a.如何配制一定比例的乙醇、乙酸和浓硫酸的混合液: _______________________。
b. 已知下列数据:
物质 | 乙酸 | 乙醇 | 乙酸乙酯 | 硫酸 |
沸点(℃) | 118 | 78.5 | 77 | 338 |
实验中采取小火加热,保持微微沸腾的目的是_________________________。
c.饱和Na2CO3溶液的作用是________________________________。
【题目】CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:
![]()
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种。生成晶种的化学方程式为_____________________。
(2)步骤②将晶种移到放有FeSO4溶液和铁皮的生长槽中,升温到60℃,吹入空气,待晶种长大到一定尺寸后,过滤、水洗、干燥,得FeOOH粉末。生长槽中放入铁皮的目的是_______,吹入空气的作用为_____________________。
(3)步骤③将FeOOH在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的___________(填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(4)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为______________________________________________。
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4·7H2O晶体。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Co2+ | 6.9 | 9.4 |
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液):
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝。
② _____________________________________________________。
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤。
④_______________________________________________________。
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4·7H2O晶体。