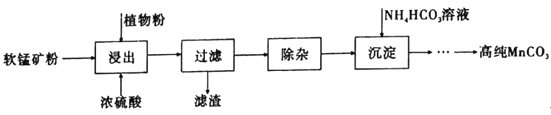
��Ŀ����
����Ŀ����ѧ��Ӧ�ǻ�ѧʵ������ı��ʣ����������ش��������⣺
��1����BaCl2��Һ��ͨ��SO2���壬δ���������ɣ�����ͨ���������е���һ�����ʣ���ͨ��SO2�ܿ�����������___(�����)��
��NO2 ��NH3 ��HCl ��FeCl3��Һ ��CO2
��2��A��B��C��D��E��������(������)������ͬһ��Ԫ�أ�����֮������ͼ��ʾ��ת����ϵ��
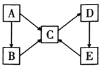
��AΪ�������ʣ�B��C���������࣬B��Һ�ʻ�ɫ�������軯����Һ��Ϻ��Ժ�ɫ��D��һ�ְ�ɫ������E��һ�ֲ����ԼB��Һ�����Ե�ԭ����___(�����ӷ���ʽ��ʾ)��ѡ����������E��Ӧʵ��E��C��ת�����÷�Ӧ�����ӷ���ʽΪ___��
��3����ͨ�������£�δ����ĥ��þ�ۺ�δ�����õ�þ������ˮ����Ӧ����Ϊ������һ�㱣��Ĥ��ȥ���������Ĥ��þ����ˮ�ͻᷢ�����Եķ�Ӧ�������д���ϸ������ݲ����������������£���Ӧ���ɵ�������ˮ��������þ�������ڱ����γ����ܱ�Ĥ�������Ӻ�Ӧ�ܿ�ֹͣ������Ӧ���Һ���ȣ�þ��ˮ�������ֻ����½��У�����ÿ��ܵ�ԭ���ǣ�___����ʱ�μӷ�̪��Һ��___(��ᡱ���ᡱ)������Һ��������
��ȡһ�β�ȥ��������Ĥ��þ������������״������ʢ��ʳ��ˮ���Թ��У����Թܵ�����ʢ��ʳ��ˮ���ձ��У�����Ѹ�ٹ۲쵽þ�������ϵظ�ˮ��Ӧ������ÿ��ܵ�ԭ����___��
��ȥ��������Ĥ�Ľ���Mg������NaHCO3��Һ����������������Һ���а�ɫ���������ɡ���������þֱ����ˮ��Ӧ��ת��ΪH2��Mg(OH)2���ܽ���ˮ�е�����Mg(OH)2�������ɵ�OH������Һ�е�HCO3����Ӧ����CO32������ʹ��Ӧ���ɵ�Mg(OH)2�����ܽ⡣��Һ��Mg2����OH����CO32�������������ɫ������Mg2(OH)2CO3�������������Ϣд��Mg��NaHCO3��Һ���ܷ�Ӧʽ��___(�����ӷ���ʽ��ʾ)��
���𰸡��٢ڢ� Fe3++3H2O![]() Fe(OH)3+3H+ 2 Fe(OH)3+6 H++2I-=2Fe2++I2+6H2O ���ȴٽ���ˮ�ĵ���ʹH+Ũ����������������Mg(OH)2���ܽ�� �� Cl-�ٽ��˷�Ӧ�ķ��� 2Mg+2HCO3-+2H2O=2H2��+CO32-+Mg2(OH)2CO3
Fe(OH)3+3H+ 2 Fe(OH)3+6 H++2I-=2Fe2++I2+6H2O ���ȴٽ���ˮ�ĵ���ʹH+Ũ����������������Mg(OH)2���ܽ�� �� Cl-�ٽ��˷�Ӧ�ķ��� 2Mg+2HCO3-+2H2O=2H2��+CO32-+Mg2(OH)2CO3
��������
(1)BaCl2��Һ��ͨ��SO2���壬δ���������ɵ�ԭ����BaSO3���������ᣬ������������˼·���ٽ�������Ϊ������BaCl2��Ӧ���ڽ���ת��ΪSO32-��BaCl2��Ӧ�������Ϸ������
(2) Fe(OH)3���������ʱ������Fe3+��I-�ᷢ��������ԭ��Ӧ��
(3)���谭þ��ˮ��Ӧ���е���Ҫ�����dz����ڱ�������ܱ�ĤMg(OH)2�����Ⱥ�ٽ���ˮ��Ҳ��ʹH+Ũ�������ӿ췴Ӧ���ʡ�ͬʱ���»�ʹ�����ܽ������ʹ֮�ܽ⣬��Ӧ���Լ�����ȥ��Mg(OH)2������ǿ�������������Һ��pHԼΪ11���ң�����ʹ��̪��졣
����ʳ��ˮ�з�Ӧ���ʼӿ���ܵ�ԭ��Cl-�ٽ��˷�Ӧ�ķ����ȣ�
��Mg��NaHCO3��Һ��Ӧ������������ʽ̼��þ��̼���ơ�
��1����NO2���������ԣ�����Һ�н�SO2����ΪSO42�����ӣ����ɳ���BaSO4���ʢ�ѡ��
��NH3��ˮ��Ӧ����NH3H2O��NH3H2O���������Ӧ����������泥���Һ�����ɴ�����SO32�����ӣ����ɳ���BaSO3���ʢ�ѡ��
��HCl��SO2������BaCl2��Ӧ��ͨ��SO2��HCl���������ɳ������ʢ۲�ѡ��
��FeCl3��Һ���������ԣ���SO2����ΪSO42�����ӣ����ɳ���BaSO4���ʢ�ѡ��
��SO2��CO2������BaCl2��Ӧ����������Ӧ���ᶼ����������ͨ��SO2��CO2���������ɳ������ʢݲ�ѡ��
��ѡ�٢ڢܣ�
��2��B��Һ�ʻ�ɫ�������軯����Һ��Ϻ��Ժ�ɫ��˵��B�к���Fe3+��AΪFe�����E��һ�ֲ����Լ��֪C�к�Fe2+��DΪFe(OH)2��EΪFe(OH)3��B�к���Fe3+��B��Һ�����Ե�ԭ����Fe3++3H2O![]() Fe(OH)3+3H+��E��C�����ӷ���ʽΪ2Fe(OH)3��2I����6H����2Fe2����I2��6H2O��
Fe(OH)3+3H+��E��C�����ӷ���ʽΪ2Fe(OH)3��2I����6H����2Fe2����I2��6H2O��
(3)���谭þ��ˮ��Ӧ���е���Ҫ�����dz����ڱ�������ܱ�ĤMg(OH)2�����Ⱥ�ٽ���ˮ�ĵ��룬ʹH+Ũ�����ӿ��˷�Ӧ���ʡ�ͬʱ���»�ʹ�����ܽ������ʹ֮�ܽ⣬��Ӧ���Լ�����ȥ��Mg(OH)2������ǿ�������������Һ��pHԼΪ11���ң�����ʹ��̪��졣
����ʳ��ˮ�з�Ӧ���ʼӿ���ܵ�ԭ��Cl-�ٽ��˷�Ӧ�ķ����ȣ�
��Mg��NaHCO3��Һ��Ӧ������������ʽ̼��þ��̼���ƣ���Ӧ�����ӷ���ʽΪ2Mg+2HCO3-+2H2O=2H2��+CO32-+Mg2(OH)2CO3��

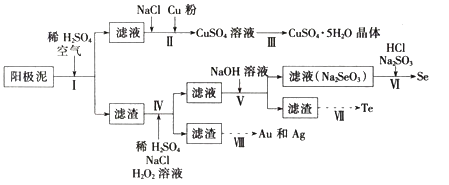
����Ŀ����ҵ�Ͽ��Դӵ��ͭ������������ȡ�ܶ���Ҫ���ʣ��乤���������£�
��֪�������������Ҫ��ѧ�ɷ֣������ʾ��
��Ҫ�ɷ� | Cu Ag Au Se Te |
�ٷֺ���/% | 23.4 12.1 0.9 6.7 3.1 |
���¶Ⱥ�����Ũ�ȶ��������и���ֽ����ʵ�Ӱ�죬�����ʾ��
�̶������¶� | �̶�H2SO4Ũ�� | |||
H2SO4Ũ�� / mol��L��1 | ������/% | �����¶�/�� | ������/% | |
Cu Ag Au Se Te | Cu Ag Au Se Te | |||
4 | 95.1 4.67 ��0.2 0.83 8.93 | 30 | 87.1 4.58 ��0.2 0.08 6.83 | |
3 | 94.5 4.65 ��0.2 0.28 6.90 | 40 | 94.5 4.65 ��0.2 0.28 6.90 | |
2 | 78.1 2.65 ��0.2 0.05 2.85 | 50 | 96.1 5.90 ��0.2 0.64 8.73 |
(1)����I����ҪĿ��Ϊ����ͭ����������Ҫ��Ӧ�Ļ�ѧ����ʽΪ__________��������2���ݣ���֪����I���ʺϵ�����Ϊ______________��
(2)����II�У�����Cu�۵�Ŀ���dz�ȥ��Һ�к��ڵ����ӣ�����NaCl��Ŀ��Ϊ________��
(3)����III�IJ�������Ϊ___________��
(4)����IV�У���Ӧ�¶�Ϊ75��������H2O2��Һ����Ϊ______________���˹�����H2O2��Һ��������ҪԶԶ��������ֵ��ԭ��Ϊ_____________��
(5)����VI����������Ӧ�Ļ�ѧ����ʽΪ_______��
(6)����VII�У����Ի����µ��Na2TeO3��Һ�ɵ�Teʵ�֣������ĵ缫��ӦʽΪ_____��