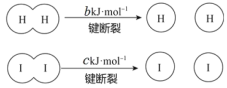
题目内容
【题目】关于下图,下列说法不正确的是
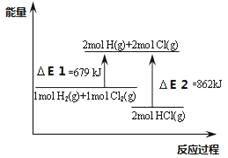
A.△E2是2mol HCl(g)的总键能
B.该反应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H =-183KJ.mol-1
C.通常情况下H2与Cl2混和不会反应
D.该反应是一个吸热反应
【答案】D
【解析】
A.△E2是形成新键时所放出的总能量,在数值上与2mol HCl(g)的总键能相同,正确;
B.根据上述能量变化图可知,该反应生成物的总能量比反应物的总能量低862 kJ.mol-1-679 kJ.mol-1=183 kJ.mol-1,则该反应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g) △H =-183kJ.mol-1,正确;
C.H2与Cl2混和要在光照或点燃条件下才能反应,正确;
D.由B可知该反应是一个放热反应,错误;
答案选D。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】Ⅰ.(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理__。
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则该温度下水的离子积常数KW=__。在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=___。
Ⅱ.工业生成尿素的原理是以NH3和CO2为原料合成尿素,反应的化学方程式为2NH3(g)+ CO2(g)![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
(1)ΔH___0(填“>”、“<”或“=”)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___。

(3)图中的B点对应的NH3的平衡转化率为__。