题目内容
【题目】Ⅰ. 工业上可通过CO和H2化合制得CH3OH: CO(g)+2H2(g) ![]() CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
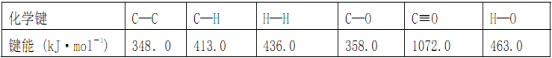
则ΔH =_____________,在相应的反应条件下,将 1 mol CO(g)与足量H2混合充分反应后,则放出或吸收的热量Q ________ ΔH 的数值(填“>”、“=”或“<”)。
Ⅱ.电化学降解NO3-的原理如右图所示。

①电源 A 极为________(填“正极”或“负极”),阴极反应式为_______________。
②若电解过程中转移了 1 mol 电子,则膜左侧电解液的质量减少量为________g。
Ⅲ.已知NO2和N2O4的相互转化反应:2NO2(g)![]() N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:

①图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化。下列不能说明该反应已达到平衡状态的是________。
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均分子量不随时间变化而改变
②前 10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min)。
③反应 25 min 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_____________(用文字表达);其平衡常数 K(d)________K(b)(填“>”、“=”或“<”)。
【答案】
Ⅰ、-116 kJmol-1;<;
Ⅱ、①正极;2NO3-+10e-+12H+=6H2O+N2↑;②9g;
Ⅲ、①X;B;②0.04;③增大NO2的浓度;=;
【解析】
试题分析:Ⅰ.CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H1=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到△H1 ═ 1072 kJmol-1 + 2 × 436 kJmol-1-(3 × 413 kJmol-1 + 358 kJmol-1 + 463 kJmol-1) = -116 kJmol-1;由于是可逆反应,平衡时1mol CO(g)反应后生成的CH3OH小于1mol,所以放出的热量小于116 kJ,故答案为:-116 kJmol-1;<;
Ⅱ、由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极,在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,故答案为:正极;2NO3-+10e-+12H+=6H2O+N2↑;
②由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极,转移1mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗0.5mol水,产生1molH+进入阴极室,阳极室质量减少9g,故答案为:9 g;
Ⅲ.①由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;容器内混合气体的体积不变,质量不变所以密度不变,因此,密度不能判断平衡;故答案为:X;B;
②X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线.由图可知,前10min内,NO2的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=![]() =0.04molL-1min-1,故答案为:0.04;
=0.04molL-1min-1,故答案为:0.04;
③由曲线看出25 min时,NO2的浓度突然增大,可知改变的条件为增大NO2的浓度;温度不变,化学平衡常数不变;故答案为:增大NO2的浓度;=;