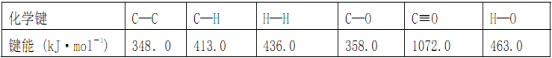
题目内容
【题目】科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。
如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-)。

(1)d电极的名称为___________,d电极上的电极反应式为____________________
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1 AgNO3溶液,a电极上的电极反应式为___________,若a电极产生560mL(标准状况)气体,则所得溶液的C(H+)=___________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入_________(填序号)其物质的量为_______mol
a Ag2O b.AgOH c.AgNO3 d.Ag2SO4
【答案】
(1)负极;CH4+4O2--8e-=CO2+2H2O
(2)4OH--4e- =2H2O+O2↑;1mol/L;a;0.05mol
【解析】
试题分析:(1)图甲是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极,甲烷失电子发生还原反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子,负极电极反应为:CH4+4O2--8e-═CO2+2H2O;故答案为:负极;CH4+4O2--8e-═CO2+2H2O;
(2)如图乙所示电解100mL0.5molL-1 AgNO3溶液,发生的电解池反应为:4AgNO3+4H2O![]() 4Ag+O2↑+4HNO3,与电源正极相连的为阳极,溶液中氢氧根离子失去电子发生氧化反应,电极反应为:4OH--4e- = 2H2O+O2↑;若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=
4Ag+O2↑+4HNO3,与电源正极相连的为阳极,溶液中氢氧根离子失去电子发生氧化反应,电极反应为:4OH--4e- = 2H2O+O2↑;若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=![]() =0.1mol/L;则所得溶液电解过程中AgNO3溶液每损失4个Ag原子,就损失2个 O原子,相当于损失一个Ag2O,为了使AgNO3溶液,恢复原浓度,应加入Ag2O,故选a;电解过程中生成氧气0.0025mol,因此加入Ag2O的物质的量为0.05mol,故答案为:4OH--4e- =2H2O+O2↑;1mol/L;a;0.05mol。
=0.1mol/L;则所得溶液电解过程中AgNO3溶液每损失4个Ag原子,就损失2个 O原子,相当于损失一个Ag2O,为了使AgNO3溶液,恢复原浓度,应加入Ag2O,故选a;电解过程中生成氧气0.0025mol,因此加入Ag2O的物质的量为0.05mol,故答案为:4OH--4e- =2H2O+O2↑;1mol/L;a;0.05mol。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案