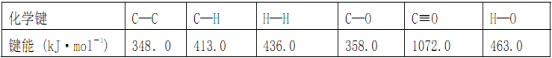
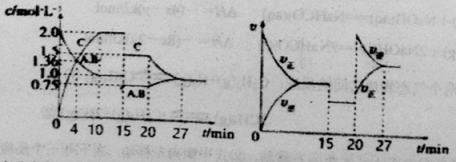
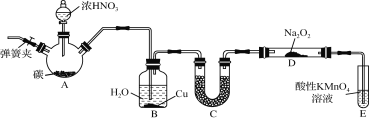
题目内容
【题目】以![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.58.5 g氯化钠固体中含有![]() 个氯化钠分子
个氯化钠分子
B.1 mol Fe参与反应失去电子数目一定为2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 个电子
个电子
D.常温下,46 g N02和N204的混合物中含有的氮原子数为![]()
【答案】D
【解析】
试题分析:A.氯化钠固体中只含有Na+和Cl-,不含有氯化钠分子,A错误;B.Fe参加反应时,有可能被氧化为+2价态,也有可能被氧化为+3价态,或者+6价态,因此失去电子数目不一定为2NA,B错误;C.1 molNa被完全氧化生成Na202,钠元素由0价变为+1价,失去NA个电子,C错误;D.N02和N204的混合物的平均摩尔质量为46g/mol,因此常温下,46 g N02和N204的混合物中含有的氮原子数为NA,D正确。故答案D。

练习册系列答案
相关题目