题目内容
1.在一定温度下,向2L密闭容器中加入1mol X和2mol Y,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| C. | 单位时间内消耗0.1mol X,同时生成0.2mol Y | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、容器内气体混合物的密度一直不随时间变化而变化,故A错误;
B、容器内X、Y、Z的浓度之比可能为1:2:2,也可能不是,与各物质的初始浓度及转化率有关,故B错误;
C、单位时间内消耗0.1mol X,等效于消耗0.2mol Y,同时生成0.2mol Y,故C正确;
D、都反映的是正反应,未体现正与逆的关系,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
12. 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 进行到3分钟时,正反应速率和逆反应速率相等 | |
| B. | 从反应开始到平衡,氢气的平均反应速率为0.225mol•L-1•min-1 | |
| C. | 达到平衡后,升高温度,正反应速率增大、逆反应速率减小 | |
| D. | 3min前v正>v逆,3min后v正<v逆 |
9. 思考下列问题,按要求填空:
思考下列问题,按要求填空:
(1)某温度下纯水中c(H+)=2×10-7mol/L,①此时溶液中的c(OH-)=2×10-7mol/L.
②若温度不变,向水中滴入稀盐酸使c(H+)=5×10-6mol/L,则此时溶液中的c(OH-)=8×10-9mol/L
(2)已知下列热化学方程式:Zn(s)+21 O2(g)═ZnO(s)△H1=-351.1kJ•mol-1;
Hg(l)+21 O2(g)═HgO(s)△H2=-90.7kJ•mol-1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变为-260.4kJ/mol
(3)在稀氨水中存在下述电离平衡NH3+H2O?NH3•H2O?NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向”、“逆向”或“不移动”)
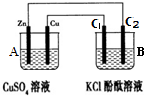
(4)如图所示,装置B中两电极均为石墨电极,试回答下列问题:
①判断装置的名称:A池为原电池.
②锌极为负极,电极反应式为Zn-2e-=Zn2+;
③当C2极析出224mL气体(标准状况下),锌的质量减少_0.65_g.
 思考下列问题,按要求填空:
思考下列问题,按要求填空:(1)某温度下纯水中c(H+)=2×10-7mol/L,①此时溶液中的c(OH-)=2×10-7mol/L.
②若温度不变,向水中滴入稀盐酸使c(H+)=5×10-6mol/L,则此时溶液中的c(OH-)=8×10-9mol/L
(2)已知下列热化学方程式:Zn(s)+21 O2(g)═ZnO(s)△H1=-351.1kJ•mol-1;
Hg(l)+21 O2(g)═HgO(s)△H2=-90.7kJ•mol-1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变为-260.4kJ/mol
(3)在稀氨水中存在下述电离平衡NH3+H2O?NH3•H2O?NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向”、“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | 减小 | 减小 | 增大 |
| 平衡移动方向 | 逆向 | 正向 | 逆向 |
①判断装置的名称:A池为原电池.
②锌极为负极,电极反应式为Zn-2e-=Zn2+;
③当C2极析出224mL气体(标准状况下),锌的质量减少_0.65_g.
16.如图有关原子或离子的结构示意图表示正确的是( )
| A. | 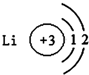 | B. | 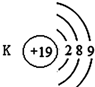 | C. | 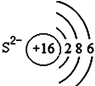 | D. | 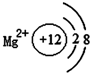 |
13.已知X、Y、Z元素的原子具有相同的电子层数,且原子序数依次增大,其最高价氧化物对应水化物酸性依次增强,下列判断正确的是( )
| A. | 最高化合价按X、Y、Z的顺序减小 | B. | 阴离子的还原性按X、Y、Z顺序增强 | ||
| C. | 单质的氧化性按X、Y、Z顺序增强 | D. | 氢化物的稳定性按X、Y、Z顺序减小 |
10.某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子.某小组在实验室中用浸出-萃取法制备硫酸铜:

(1)操作II、操作III的主要目的是除去杂质、富集铜元素.
(2)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂 Cu2(0H)2C03悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(0H)6S04.已知Cu(0H)2、Cu2(OH)2CO3、Cu4(0H)6S04均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃,设计实验检验悬浊液成分,完成表中内容.
限选试剂:2mol.L-1 HCl、1mol.L-1 H2SO4、O.1mol.L-1 NaOH、0.1mol.L-1 BaCl2、蒸馏水.仪器和用品自选.

(1)操作II、操作III的主要目的是除去杂质、富集铜元素.
(2)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂 Cu2(0H)2C03悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(0H)6S04.已知Cu(0H)2、Cu2(OH)2CO3、Cu4(0H)6S04均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃,设计实验检验悬浊液成分,完成表中内容.
限选试剂:2mol.L-1 HCl、1mol.L-1 H2SO4、O.1mol.L-1 NaOH、0.1mol.L-1 BaCl2、蒸馏水.仪器和用品自选.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol.L-1HCl,充分振荡,再加0.1mol.L-1BaCl2溶液 | 说明悬浊液中混有白色沉淀产生,有Cu4(0H)6S04. |
| 步骤2:另取少量悬浊液于试管中将试管放入装有沸水的小烧杯中,用水浴加热一段时间,取出试管观察 | 试管中黑色沉淀生成,说明悬浊液中混有Cu(0H)2. |
11.下列各组离子在水溶液中能够大量共存的是( )
| A. | Ba2+、SO42-、SO32- | B. | Na+、C1-、OH- | ||
| C. | NH4+、OH -、SO42- | D. | H+、CO32-、NO3- |
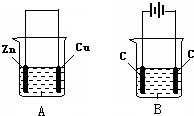 按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: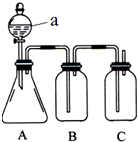 某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液