题目内容
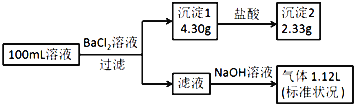
【题目】![]() 某元素的氯化物
某元素的氯化物![]() 溶于水制成溶液后,加入
溶于水制成溶液后,加入![]() 溶液恰好完全反应。已知该元素原子核内有20个中子,求X元素的质子数___和质量数___,并写出X元素在元素周期表中的位置(简要写出计算过程)___。
溶液恰好完全反应。已知该元素原子核内有20个中子,求X元素的质子数___和质量数___,并写出X元素在元素周期表中的位置(简要写出计算过程)___。
【答案】20 40 第四周期第ⅡA族
【解析】
根据XCl2+2AgNO3=X(NO3)2+2AgCl↓计算XCl2的物质的量,再由M=![]() 计算其摩尔质量,摩尔质量与相对分子质量的数值相等,原子的质量数为原子的近似相对原子质量,结合该原子原子核内有20个中子,根据质子数=质量数
计算其摩尔质量,摩尔质量与相对分子质量的数值相等,原子的质量数为原子的近似相对原子质量,结合该原子原子核内有20个中子,根据质子数=质量数![]() 中子数来计算原子的质子数,利用质子数确定元素在周期表中的位置。
中子数来计算原子的质子数,利用质子数确定元素在周期表中的位置。
n(AgNO3)=0.02L![]() 1mol/L=0.02mol,
1mol/L=0.02mol,
XCl2+2AgNO3=X(NO3)2+2AgCl↓
1mol 2mol
n(XCl2) 0.02mol
n(XCl2)=0.01mol,
所以M(XCl2)=m(XCl2)/n(XCl2)=![]() =111g/mol,所以XCl2相对分子质量为111,
=111g/mol,所以XCl2相对分子质量为111,
因为XCl2中有两个Cl,所以X的质量数=111-35.5![]() 2=40,
2=40,
所以X的质子数=质量数![]() 中子数=40-20=20,质子数是20为钙元素。钙元素在元素周期表中位于第四周期第ⅡA族,
中子数=40-20=20,质子数是20为钙元素。钙元素在元素周期表中位于第四周期第ⅡA族,
因此,本题正确答案为20 ;40 ;第四周期第ⅡA族。

练习册系列答案
相关题目